SOLUCCIONES AUXILIARES DE LA BIOMECÁNICA
DE LOS CONDUCTOS RADICULARES
Profesor Titular de Endodoncia FORP-USP (Ribeirão Preto- São Paulo-Brasil)
Tradução:
Prof. Dr. Marcos Jacobovitz.
PREPARACIÓN BIOMECÁNICA DE LOS CONDUCTOS
RADICULARES
CLASIFICACIÓN DE LAS SOLUCIONES
HIPOCLORITO DE SODIO
TENSOACTIVOS
QUELANTES, ÁCIDOS Y PERÓXIDOS
ASOCIACIONES DE SOLUCIONES
REFERENCIAS
Introducción
Preparación biomecánica de los conductos radiculares
Los términos “preparación mecánica”,
“preparación químico-mecánica”, “instrumentación”, “limpieza y forma”, “biomecánica”
son utilizados indistintamente en Odontología, a pesar que en la II a.
Convención Internacional de Endodoncia realizada en la Universidad de
Pennsylvania, Filadelfia, USA en 1953, se estableció como correcto el término
BIOMECÁNICA de los conductos radiculares. El término “biomecánica” es
justificado por que este acto operatorio es realizado con principios y
exigencias biológicas.
Callahan (1894), Grossman (1943,1960),
Stewart (1955), Ingle & Zeldow (1958) y Nichols (1962), presentaron etapas
o secuencias del tratamiento endodóntico que, fundamentalmente, consisten en la
instrumentación, la ampliación del conducto radicular, su desinfección y
obturación. Para esos autores no hay etapa más importante que las demás. Todas
están correlacionadas y cualquier descuido
en una de ellas podrá provocar el fracaso del tratamiento endodóntico.
Autores como Auerbach (1953), Stewart
(1955), Vella (1955) consideran la preparación biomecánica como siendo la fase
más importante del tratamiento endodóntico. Leonardo (1991), con base en
diversas investigaciones científicas, comparte de la idea del relevante papel
de la preparación biomecánica de los conductos radiculares.
Existe un axioma en endodoncia, cuya
afirmación es atribuida a Sachs, citado por Schilder (1982) y Leonardo &
Leal (1991) que dice: “Lo más importante en la terapia de los conductos
radiculares es lo se lo quita de su interior y no lo que en ello se pone”. Es
claro que este axioma no pretende minimizar la importancia de las otras fases del tratamiento endodóntico. La verdad
es que la obturación de los conductos radiculares no puede ser conseguida sin
que los mismos hayan sido preparados adecuadamente para recibir el material
obturador.
La preparación biomecánica es realizada
por medio de la instrumentación manual y/ o mecánica del conducto radicular
utilizando los ensanchadores, limas y fresas asociados a soluciones irrigadoras
que presentan propiedades químicas más específicas para cada caso en
particular. Así, la biomecánica de los conductos radiculares podría ser mejor
comprendida como preparación bioquímico-mecánica de los conductos radiculares.
Leonardo y Leal (1991) citan las siguientes finalidades de la preparación
biomecánica:
Finalidades
de la Preparación Biomecánica en las Pulpectomías:
·
Combatir la
posible infección superficial de la pulpa.
·
Remover la
pulpa coronaria y radicular, restos pulpares, sangre infiltrados en los
canalículos dentinarios.
·
Prevenir el
oscurecimiento dental
·
Rectificar,
lo más posible, las curvaturas del conducto radicular.
·
Preparar el
stop apical (escalón apical).
·
Ensanchar y
alisar las paredes del conducto dentinario, dándole conformación cónica y
preparándolo para recibir la obturación.
·
Remover las
virutas de dentina y smear-layer
producidos durante la instrumentación del conducto radicular.
·
Preservar la
vitalidad del muñón pulpar, ramificaciones laterales, secundarias y accesorias.
Finalidades de la preparación biomecánica
en las Necropulpectomías (penetración desinfectante):
·
Neutralizar
el contenido tóxico de la cavidad pulpar.
·
Remover por
medio mecánico y químico los microorganismos y sus productos, reduciendo la
microflora del conducto radicular.
·
Remover
restos necróticos, dentina infectada y emblandecida. Ensanchar y alisar las
paredes dentinarias del conducto radicular, dándole forma cónica.
·
Remover por
medio mecánico y químico los microorganismos y sus productos, reduciendo la
microflora del conducto radicular.
·
Rectificar
lo más posible las curvaturas del conducto radicular. Remover virutas de
dentina y el “smear layer”, permitiendo mayor contacto de los materiales obturadores con las paredes
dentinarias del conducto radicular.
La preparación biomecánica, para su
ejecución, utiliza los siguientes
medios:
1º Mecánico–acción de
los instrumentos en el conducto radicular, aplicación de técnicas de
instrumentación.
2º Físico-consiste en el acto de irrigar y
aspirar una solución irrigadora - movimiento hidráulico.
3º Químico-acción química de las soluciones
irrigadoras.
Los medios químicos y físicos son auxiliares del medio mecánico. El medio
físico comprende el movimiento hidráulico de un líquido circulante -
irrigación/aspiración. El medio químico corresponde a la acción de las
propiedades químicas que las soluciones irrigantes presentan. Esas propiedades
químicas dan a las soluciones irrigantes la calidad de auxiliar, pues ellas
actuarán en el interior del conducto radicular como antisépticas, solventes de
tejidos, quiera orgánico como inorgánico, cambian el pH del medio, etc.
Así, la escoja de una solución irrigante
no es aleatoria. Ella debe estar relacionada con el caso en cuestión, para obtener un mejor resultado relactivo a la
limpieza y desinfección. Es muy
importante que el profesional conozca a las propiedades químicas de las
soluciones irrigantes para seleccionarlas y utilizarlas de la mejor manera
posible, en cada caso en particular.
Clasificación de las Soluciones
Los medios químicos utilizados en la preparación biomecánica de los conductos
radiculares se dan por las soluciones irrigantes de los conductos radiculares.
Entre esas soluciones auxiliares de la instrumentación endodóntica, las más
comúnmente empleadas en Endodoncia son los compuestos halogenados,
tensoactivos, quelantes, ácidos y peróxidos además de asociaciones y/o misturas
de esas substancias.
![]() 1 - Compuestos
Halogenados:
1 - Compuestos
Halogenados:
·
1.1
Soluciones de hipoclorito de sodio (NaOCl) en diferentes concentraciones de
cloro activo:
·
NaOCl al 5%
(soda clorada)
·
NaOCl al
2,5% (solución de Labaraque)
·
NaOCl 2 al 2,5% (blanqueadores)
·
NaOCl al 1%
·
NaOCl al
0,5%
·
1.2 NaOCl al
1% con 16% de cloruro de sodio (Solución de Milton)
·
1.3 NaOCl al
0,5% con ácido bórico para reducir el pH (Solución de Dakin)
·
1.4 NaOCl al
0,5% con bicarbonato de sodio para reducir el pH (Solución de Dausfrene)
·
1.5
Clorhexidina
![]() 2 -
Tensoactivos :
2 -
Tensoactivos :
·
2.1
Tensoactivos Aniónicos
Los tensoatcivos aniónicos son compuestos en los cuales la cadena grasa
hidrofóbica está anexada a un grupo hidrófilo cargado negativamente.
§
2.1.1 Lauril
sulfato de sodio (Texapon)
§
2.1.2 Lauril
dietileno glicol eter sulfato de sodio
La solución acuosa de Lauril dietileno glicol éter sulfato de sodio al 0,125%
es denominada de Tergentol.
·
2.2
Tensoactivos Catiónicos :
Los tensoactivos catiónicos son compuestos que presentan el grupo polar o
"cabeza" con carga positiva.
§
2.2.1 Cetavlon
(bromuro de cetiltrimetilamonio)
El cetavlon es adicionado en las soluciones de EDTA-C con la finalidad de
reducción del potencial hidrogeniónico (pH).
§
2.2.2
Dehyquart A (cloruro de cetiltrimetilamonio)
§
2.2.3
Biosept (cloruro cetil piridino)
§
2.2.4
Zefirol (cloruro de benzalconio)
·
2.3
Tensoactivos Neutros:
Los tensoactivos neutros o no iónicos son compuestos en los cuales la cadena
grasa hidrofóbica está anexada a un grupo hidrófilo sin carga.
·
2.3.1 -
Tween 80
![]() 3 -
Quelantes:
3 -
Quelantes:
§
3.1 EDTA
§
3.2 Salvizol
(tensoactivo quelante)
![]() 4 -
Ácidos:
4 -
Ácidos:
§
4.1 Ácido
Cítrico
![]() 5 -
Peróxidos:
5 -
Peróxidos:
§
5.1 Peróxido
de hidrogeno
§
5.2 Peróxido
de urea
![]() 6 -
Asociaciones y/o mixturas:
6 -
Asociaciones y/o mixturas:
·
6.1 -
Detergente aniónico + hipoclorito de sodio
·
6.2 -
Detergente aniónico + nitrofurazona ( Tergentol/Furacin)
·
6.3 -
Detergente aniónico + Hidróxido de calcio (Irrigocal y Tergidrox)
·
6.4 -
Detergente aniónico + EDTA (Paiva & Antoniazzi 1984)
·
6.5 -
Hipoclorito de sodio alternado con peróxido de hidrogeno (Reacción de Grossman
1943).
·
6.6 -
Hipoclorito de sodio + ácido cítrico (Loel 1975)
·
6.7 -
Detergente catiónico + EDTA = EDTAC
·
6.8 -
Peróxido de urea + EDTA + Carbowax (RC-PREP) neutralizado con hipoclorito de
sodio al 5%, Stewart et al 1969
·
6.9 -
Peróxido de urea + Tween 80 + Carbowax neutralizado con hipoclorito de sodio
(Solución de Dakin ). Paiva & Antoniazzi 1973.
![]() 7 -
Otras Soluciones:
7 -
Otras Soluciones:
§
7.1 - Agua
destilado
§
7.2 - Suero
fisiológico
§
7.3 -
Solución de hidróxido de calcio al 0,14%
Compuestos Halogenados:
Los compuestos halogenados son así llamados
por poseer elementos químicos en sus moléculas pertenecientes al grupo de los
halógenos de la tabla periódica. El elemento químico cloro, por ejemplo, hace
parte del grupo de los halógenos. El uso de los compuestos halogenados se inició en 1792 cuando se produjo, por la primera vez, una solución
conteniendo iones hipoclorito que recibió el nombre de “Agua de Javele”. Ese
hipoclorito se constituía de una mixtura de hipoclorito de sodio e potasio.
En 1820,
Labarraque, químico francés, obtuvo el hipoclorito de sodio con 2,5% de cloro
activo y esa solución pasó a ser utilizada con antisépticos para heridas. En
1915, Dakin, químico americano, durante la Primera Guerra Mundial, con base en
investigaciones propuso una nueva solución de hipoclorito de sodio al 0,5% de
cloro activo neutralizado con ácido bórico. Esa nueva solución se quedó conocida con el nombre del autor -
Solución de Dakin. Dakin (1915) observó que al tratar heridas de guerra con
hipoclorito de sodio al 2,5% (Solución de Labarraque), se obtenía antisepsia, pero la cicatrización de
la herida era demorada. Para verificar lo que ocurría, él diluyó la solución
hasta la concentración de 0,5% de cloro activo y la utilizó con la misma finalidad. Sus observaciones pudieron
constatar que en esta concentración se
obtenía el mismo resultado, o sea, antisepsia de la herida pero la
cicatrización era lenta. Él observó que la demora de cicatrización era debida
al grande tenor de hidróxido de sodio presente en las soluciones de
hipoclorito, independiente de su concentración. Con base en este raciocinio,
Dakin asoció la solución de hipoclorito de sodio al 0,5%, cuyo pH era 11, con
ácido bórico (0,4%). El hecho posibilitó una solución de hipoclorito de sodio
con pH próximo al neutro. De esa manera, con el uso de una solución de
hipoclorito de sodio con pH próximo del neutro se logró desinfección de las
heridas sin el efecto indeseable de la acción de las hidroxilas sobre los
tejidos vivos.
Él verificó que el hipoclorito de sodio,
quiera al 2,5% o al 0,5% tenían pH
extremamente próximos en virtud de las hidroxilas libres. Con la adición del
ácido bórico ocurría la formación del borato de sodio en la solución, evitando
así la presencia de hidroxilas libres irritantes de los tejidos. Es oportuno
frisar que la solución de Dakin es una
solución de hipoclorito de sodio neutralizada con ácido bórico. Cuando se
utiliza una solución de hipoclorito de sodio al 0,5%, no significa
necesariamente que se está usando la solución propuesta por Dakin.
La
solución de hipoclorito de sodio con pH elevado, al rededor de 11 a 12, es más
estable y la liberación de cloro es más lenta. Al paso que se reduce el pH de
la solución, quiera por medio del ácido bórico o del bicarbonato de sodio
(Solución de Dausfrene), la solución
queda mucho más inestable y la pérdida de cloro es más rápida. Esto
significa que el tiempo de vida útil de la solución es pequeño.
Bajo la luz solar y en temperatura elevada ocurre la liberación de cloro
dejando la solución ineficaz. Pécora y cols. (1986 e 1987) estudiaron el "shelf life" (tiempo de vida) de la
solución de Dakin almacenada en vidrio ámbar en diversas condiciones de
temperatura, o sea, a la luz solar, a la sombra en temperatura ambiente y, en
ausencia de luz dentro de heladera a 9
grados centígrados. Ellos observaron que después de 4 meses la solución perdía
un 80% de su tenor de cloro cuando expuesta a la luz solar, un 60% a la
temperatura ambiente y, solamente un 20% cuando conservada a baja temperatura y
en ausencia de luz. Esos autores, también, verificaron que a penas un 30% de
las marcas comerciales testadas presentaban tenor de cloro dentro de las
especificaciones, o sea, superior al 0,4%.
Cuando una solución de hipoclorito de sodio presenta tenor de cloro abajo del
0,3% ella no es efectiva contra Candida
albicans y Enterococcus faecalis. En concentraciones de 0,5% ellas son
efectivas en contra esos microorganismos en un tiempo de acción de 15 segundos
(Monteiro-Souza et al, 1992).
Así, se debe
resaltar la importancia de
conocerse la concentración del
hipoclorito de sodio que se va a utilizar en la terapéutica endodóntica
para que se obtenga las reales ventajas
que esas soluciones pueden ofrecer cuanto a la limpieza y desinfección.
En laboratorios, se utiliza el método de la titulometría por el iodo para evaluar la concentración de cloro activo de las soluciones de
hipoclorito de sodio. La titulometría, sin embargo, es muy problemática
para ser utilizada en un consultorio odontológico en virtud de las soluciones y
aparatos necesarios. Así, para conocerse de modo rápido, práctico y económico y
con relativa precisión, se puede utilizar el método de la volumetría presentado
por Paiva y cols. (1989). El método de
la volumetría puede ser realizado en cualquier consultorio y necesita de los
siguientes materiales: dos jeringas Luer (una de 10 mL y otra de 3mL), una
aguja, detergente de cocina y agua oxigenada al 3%. El "modus operandi" es lo que se sigue:
la jeringa Luer de 10 mL debe ser transformada en un tubo de ensayo,
desechándose el émbolo y cerrando el local de posicionamiento de la aguja. En
su interior se debe poner 1 mL de agua oxigenada e tres a cuatro gotas de
detergente. En seguida, se coloca 2,8
mL de la solución de hipoclorito de sodio a ser testado. Después de esto, se
agita el tubo y se lo deja en reposo
por un minuto. Posteriormente, se mide la columna de espuma formada por medio
de una regla. El resultado obtenido, en centímetros, debe ser dividido por diez
y se tiene, así, el tenor de cloro activo aproximado de la solución testada. La
verificación del tenor de cloro activo es importante, pues el odontólogo no
debe utilizar producto fuera de la especificación, pues el resultado da
terapéutica endodóntica puede quedarse comprometido.
Las soluciones de hipoclorito de sodio tuvieron, siempre buena aceptación como
solución irrigante de conductos radiculares y Walker en 1936 presentó su
técnica de irrigación que consistía en el uso de hipoclorito de sodio al 5%
como solución auxiliar de la instrumentación. Con base en las observaciones de
Walker (1936), Grossman & Meinam (1941) realizaron un estudio para
verificar la capacidad de solvencia de tejidos orgánicos de las soluciones
irrigantes utilizadas hasta aquella época. Ellos pusieron pulpas en las siguientes
soluciones: dióxido de sodio (Kirk, 1893), ácido sulfúrico (Callahan, 1894),
(Halarn, 1900), hipoclorito de sodio (Walker, 1936). Después de los
experimentos, esos autores han concluso que el hipoclorito de sodio al 5% (soda clorada) era capaz de disolver
tejido pulpar más rápidamente que cualquiera de las soluciones testadas.
A seguir, en 1943, Grossman propuso una técnica de irrigación de conductos
radiculares que resiste a la crítica por cincuenta años y consiste en el uso
alternado de una solución de hipoclorito de sodio al 5% con el peróxido de
hidrogeno al 3% (10 volúmenes). En esta técnica, la irrigación comienza y
termina con la solución de hipoclorito de sodio a fin de evitar la liberación
tardía de oxigeno naciente, o sea, después de la curación entre sesiones. La reacción química entre
las soluciones de hipoclorito de sodio y peróxido de hidrogeno libera oxigeno
naciente, es efervecente y exotérmica . La
exotermía de esta reacción química fue demostrada por Costa en 1986 y Barbin y cols.
(1995). El oxigeno naciente generado dentro del sistema de conductos
radiculares es importante para la acción antiséptica en contra microorganismos
anaerobios. Auerbach (1953) comparó, por medio de testes bacteriológicos, la
eficacia de la técnica de irrigación propuesta por Grossman (1943), obteniendo
alto porcentaje de testes negativos inmediatamente después de la
instrumentación.
La capacidad de la solución de hipoclorito de sodio en disolver tejidos
orgánicos fue estudiada por diversos investigadores, entre los cuales podemos
citar: Senia (1971), Hand y cols. (1978), Cunninghan & Balakejan (1980),
Abou-Rass y cols. (1981), Spanó (1999),
Santos (1999)
y Barbin (1999).
Spanó (1999) testó la capacidad solvente de las soluciones de hipoclorito de sodio
en las concentraciones de 0,5 - 1,0 - 2,5 e 5,0% en pulpas bovinas y observó
que la capacidad solvente es directamente proporcional a la concentración de la
solución de hipoclorito de sodio, o sea, cuanto mayor la concentración de esa
solución tanto mayor será la capacidad solvente.
Santos (1999) evaluó la capacidad solvente en pulpas bovinas de las soluciones
de hipoclorito de sodio según la variación de temperatura. Constató que la
capacidad solvente es directamente proporcional a la temperatura, esto es,
cuanto más elevada la temperatura de la solución de hipoclorito de sodio tanto
mayor será su capacidad solvente.
Barbin (1999) estudió la capacidad solvente de las soluciones de hipoclorito de
sodio adictivadas con tensoactivo (lauril dietilenoglicol éter sulfato de
sodio) observando que la adición de tensoactivos disminuía la capacidad
solvente de las soluciones de hipoclorito de sodio.
El hipoclorito de sodio no existe en el estado de polvo, pero solamente en
solución acuosa. Estando en solución acuosa, se encuentra en un equilibrio
químico dinámico, donde puede presentarse como
sal no disociado, dando origen a otras substancias o presentándose
también totalmente disociado. Esta solución acuosa de hipoclorito de sodio,
debido a su equilibrio químico dinámico, puede ser representada por la
siguiente reacción química:
NaOCl
+ H2O <==> NaOH + HOCl <==> Na+ + OH- + H+ + OCl- ==> O2 + Cl2
(Reacción I)
Las reacciones químicas entre los componentes del tejido pulpar y las
substancias presentes en la solución de hipoclorito de sodio que pueden ser
responsables por el proceso de disolución tejidual, pueden ser vistas abajo:
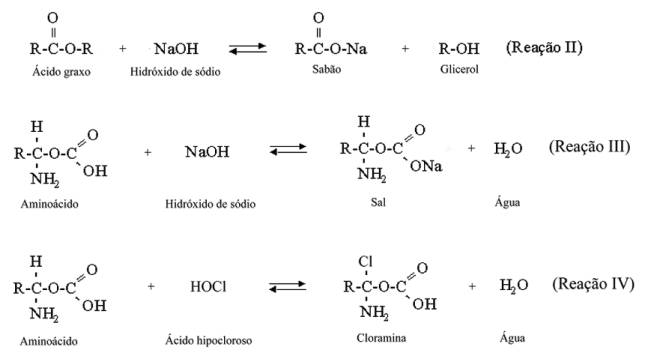
Por el análisis o interpretación de las reacciones I a IV se puede entender las
acciones del hipoclorito de sodio:
·
El hidróxido
de sodio es un potente solvente orgánico y de grasas formando jabones
(saponificación).
·
El ácido hipocloroso
es un potente agente antimicrobiano por liberar cloro naciente que se combina
con el grupo amina de las proteínas, formando las cloraminas. El ácido
hipocloroso (HOCl) sufre descomposición por la acción de la luz, del aire y del
calor liberando cloro libre y,
secundariamente oxigeno naciente.
·
Neutraliza
productos tóxicos - actúa sobre las proteínas.
·
Bactericida,
libera cloro y oxigeno naciente.
·
pH alcalino
- Neutraliza la acidez del medio, tornándolo impropio para el desarrollo
bacteriano.
·
Deshidrata y
solubiliza las proteínas,
transformándolas en materiales fácilmente removibles.
·
No irrita
los tejidos vivos (solución de Dakin) y las soluciones más concentradas pueden
y deben ser usadas en dientes con pulpas necróticas con y sin lesiones periapicales.
·
Agente
clareante - potente fuente de agente oxidante.
·
Agente
desodorizante por actuar sobre productos en descomposición.
La disolución del
tejido pulpar por el hipoclorito de sodio es fundamental pues el campo
operatorio en la Endodoncia es compuesto por un sistema de conductos
radiculares siendo que grande parte de ese sistema es inaccesible a los
instrumentos endodónticos. La disolución del tejido acaba por ayudar en la
limpieza endodóntica por la transformación de substancias insolubles (tejido
pulpar y restos necróticos) en substancias solubles como los jabones,
cloraminas y sales de aminoácidos además de la acción de los jabones producidos
en la reacción que mantiene cuerpos grasosos en suspensión (micelas) pasibles
de ser aspirados. La capacidad de limpieza de los conductos radiculares
proporcionada por el uso de soluciones de hipoclorito de sodio fue investigada
por McComb y cols. (1975), Tucker y cols. (1976), Moodnik y cols. (1976), Crabb
(1982), Yamada y cols. (1983), Costa y cols. (1986), entre otros. El
hipoclorito de sodio en las más diferentes concentraciones posibilitan
evidenciar mayor aumento de la permeabilidad dentinaria y este hecho fue
constatado por varios investigadores entre ellos Robazza (1973) y Pecora (1985 e 1990).
Las investigaciones de Spanó (1999),
Santos (1999)
y Barbin (1999)
también evaluaron el potencial hidrogeniónico, la conductividad iónica, la
tensión superficial y los tenores de cloro antes e después del proceso de disolución pulpar. El estudio de
esas propiedades físico-químicas llevaron a interesantes constataciones, tales
como: el proceso de disolución pulpar consume iones hidroxila lo que apunta
para la ocurrencia de la reacción de saponificación de grasas; hubo reducción
de la cantidad de iones después la disolución lo que indica la formación de
compuestos moleculares como las cloraminas (que poseen acción antiséptica;
ocurre reducción de la tensión superficial después de la disolución lo que
demuestra la ocurrencia de reacción de saponificación entre el hipoclorito de
sodio y el tejido pulpar; y la cantidad de cloro libre disminuye después de la
disolución lo que marca la participación y/o liberación do cloro libre durante
la reacción de disolución pulpar.
Santos (1999) notó que la cantidad de cloro libre en las soluciones utilizadas
en temperaturas más elevadas después de la disolución era muy reducida
indicando una participación activa de esa sustancia en el proceso de disolución
y/o una liberación abundante de cloro dentro de los conductos radiculares lo
que promovería acción antiséptica.
Barbin (1999) observó que las soluciones
de hipoclorito de sodio adictivadas con tensoactivo sufrían aumento de la
tensión superficial después la disolución tejidual lo que relaciona la peoría
en la capacidad solvente por la adicción de tensoactivo con la disminución de
la reacción de saponificación. Se sabe que antes de la disolución pulpar, la
solución de hipoclorito de sodio posee tensión superficial poco menor que del agua (Guimarães y cols., 1987 y Pécora y
cols., 1992).
Las actividades del ácido hipocloroso dependen del pH. En medio ácido o neutro
predomina la forma ácida no disociada (inestable y más activo , HOCl). En medio
alcalino prevalece la forma ionica disociada (estable y menos activa). Por ese
motivo el "shelf-life" de
las soluciones de hipoclorito de sodio con pH elevado es más estable y las de
pH próximo del neutro (solución de Dakin) tiene vida útil muy pequeña. El
líquido de Dakin presenta hipoclorito de sodio neutralizado con ácido bórico
presenta gran cantidad de ácido hipocloroso debido al siguiente proceso
químico:
3NaOCl + H3BO3 ==>
Na3BO3 + 3HOCl
Por lo tanto, en las soluciones de hipocloritos de sodio no neutralizados se
tiene mayor concentración de hidróxido de sodio (NaOH) y menor de ácido
hipocloroso (HOCL) y en los hipocloritos neutralizados se tiene el inverso, o
sea, menor cantidad de NaOH y mayor de HOCl.
Moorer & Wessenlink (1992), verificaron los factores que influyen en la
capacidad de la solución de hipoclorito de sodio en disolver tejido orgánico.
Ellos han constatado que el principio activo de esa solución depende de las
moléculas de ácido hipocloroso (HOCl). Con todo, Spanó (1999), Santos (1999)
y Barbin (1999) en contraste con Moorer & Wessenlink
(1992), responsabilizaron la acción conjunto del hidróxido de sodio con
el ácido hipocloroso por la disolución pulpar pues ambos son consumidos en la
interacción hipoclorito de sodio con la materia orgánica. Los autores han
concluso que el poder de la solución de hipoclorito de sodio en disolver tejido
orgánico depende, fuertemente, de los siguientes factores:
o
Cantidad de
materia orgánica e hipoclorito presente;
o
Frecuencia e
intensidad de flujo irrigante y,
o
Superficie
de contacto entre el tejido y solución de hipoclorito de sodio.
Por ese motivo, la irrigación de
conductos con hipoclorito de sodio, en las varias concentraciones, debe ser
abundante para obtenerse el máximo efecto.
Leonardo
& Leal (1991) indican, en su libro, el uso de hipoclorito de sodio (4-6%)
para:
Neutralizar
productos tóxicos con la función de posibilitar la penetración quirúrgica
inmediata en los conductos radiculares en dientes con reacción periapical
crónica evidenciable radiográficamente.
Como
coayudante de la preparación biomecánica de los conductos radiculares de
dientes despulpados e infectados, en función de su acción bactericida.
Durante
la remoción de obturaciones parciales del conducto radicular.
En
casos del uso de la técnica de Grossman (1943) y Stewart y cols. (1969).
Continuando, eses autores indican el uso del hipoclorito de sodio al 0,5%
(solución de Dakin) y al 1% (solución de Milton) para la neutralización del
contenido séptico pulpar, en casos de tratamiento endodóntico de dientes
despulpados e/o infectados sin periapicopatias evidenciable radiográficamente.
La biocompatibilidad de las soluciones de hipoclorito de sodio está inversamente relacionada con su concentración, o sea, cuanto menor la concentración tanto mayor la biocompatibilidad de los hipocloritos de sodio. Esa propiedad recibió especial atención de Spangberg y cols. (1973), Nery y cols. (1974), Wennberg (1980) y Rosa y cols. (1975).
La escoja de la concentración del hipoclorito de sodio a ser utilizada varía
entre la biocompatibilidad de las menores concentraciones y la eficacia de las
mayores concentraciones. Esa búsqueda pasa por la evidencia de la existencia
del cloro activo en la solución, que depende de varios factores involucrados en
la distribución comercial de ese producto.
Las indicaciones de la utilización de las soluciones de hipoclorito de sodio en
las diferentes concentraciones, se
cambian entre escuelas. En Estados Unidos, Schilder (1982) relató que el
hipoclorito de sodio es la solución irrigadora más importante para la limpieza
y desinfección de los conductos radiculares. El uso del hipoclorito de sodio en
las concentraciones de 0,5 y 1% fue y
permanece siendo utilizada en medicina a más de 75 años.
En Brasil, el clima caliente y las características de distribución y almacenaje de los productos odontológicos en los establecimientos comerciales causan el problema de la utilización de la solución de hipoclorito de sodio con el tenor de cloro activo menor que el necesario. Eso se debe a la instabilidad de las soluciones de hipoclorito de sodio que es agravada por el calor del clima, por el tiempo de almacenaje en tiendas especializadas de productos odontológicos y hasta por el empaquetamiento en frascos inadecuados (el frasco adecuado debe ser de color ámbar u opaco). Esa situación provocó la búsqueda por una solución comercial de hipoclorito de sodio con tenor de cloro confiable, de fácil acceso y financieramente accesible. El producto que atiende a esos requisitos es el blanqueador, hipoclorito de sodio en la concentración del 2 al 2,5 % (ej. Clorox).
Marchesam y cols. (1998) evaluaron
algunas propiedades físico-químicas de los blanqueadores encontrados en el mercado
brasilero y observaron que todos ellos presentaban concentración de cloro libre
de acuerdo con el fabricante (entre 2 y
2,5 %). El análisis de las propiedades físico-quimicas, pH, conductividad
ionica y tenor de cloro activo mostraron también enorme semejanza entre ellas.
A través de eses hallazgos, fue autorizada la utilización de blanqueadores como
solución auxiliar en la biomecánica de los conductos radiculares. A pesar que
no hayan sido encontradas partículas de suciedad en blanqueadores estudiados,
se podría filtrar la solución antes de
su utilización por medio de embudo y filtro de papel o torunda de algodón. Cabe
frisar que algunos cuidados deben ser observados cuando se compra y utiliza
blanqueadores para utilización en la terapéutica endodóntica, como, por
ejemplo: no utilizar blanqueadores con colorantes o esencias odoríferas y no
emplear lo mismo frascos de blanqueador tanto para servicios generales cuanto
para terapia endodóntica para salvaguardar la bioseguridad.
Los
blanqueadores por tener concentración entre 2 y 2,5 % son más efectivos pero
pueden provocar irritabilidad tejidual y compromiso del muñon pulpar y
ramificaciones laterales, secundarias y accesorias en pulpectomías. Eso llevó a
Marchesam y cols. (1998)
a buscar un factor de dilución, o sea, una forma simple de dilución del
blanqueador con la finalidad de
obtenerse una solución de hipoclorito de sodio con la concentración
aproximada del 1,0%. Independientemente de la marca comercial, la dilución del
blanqueador para una concentración del 1,0% puede ser hecha fácilmente en el
consultorio añadiéndose 5 partes del producto para 2 partes de agua filtrada
(agua potable). Se recomienda filtrar el producto con una torunda de algodón o
filtro de papel para eliminar posibles impurezas. Hay que informar que
blanqueadores con colorantes o perfumados no deben ser utilizados. Se debe
aguardar un período de 30 minutos después de la dilución para la utilización de
la solución de hipoclorito de sodio al 1,0% en la práctica clínica. El
empaquetamiento de esa solución necesitará ser hecho en recipiente que impida
la pasaje de luz (vidrio ámbar o plástico opaco) y el almacenaje, en local
fresco y fuera del alcance de la luz solar. La heladera sería la mejor opción
de almacenaje (PÉCORA y
cols. 1987) pero la solución
debe estar en la temperatura ambiente para la terapéutica.
Como ya fue
dicho, las soluciones de hipoclorito de sodio, en diferentes concentraciones,
son las más utilizadas como soluciones auxiliares de la instrumentación de
conductos radiculares y nuevos comentarios sobre ellas serán realizados durante
el tópico de las asociaciones y mixturas.
La
clorhexidina puede ser considerada un compuesto halogenado una vez que contiene
cloro en su molécula. El cloro pertenece, en la tabla periódica, a la familia
de los halógenos. En Odontología, la clorhexidina es usualmente utilizada en
solución acuosa de 0,2 hasta 2,0%. Esas soluciones son incolores e inodoras,
pero estables en pH de 5 al 8, teniendo la mayor eficiencia antibacteriana en pH
alrededor de 5,5 al 7. El soluto más común de las soluciones de
clorhexidina es el sal digluconato de clorhexidina.
La clorhexidina
posee acción anti bacteriana de amplio espectro y presenta sustantividade, o
sea, se liga a la superficie del esmalte y dentina como también a las glicoproteínas y, a medida en que la concentración de esa sustancia en
el medio caie, ella se mueve para el
medio a fin de mantener una
concentración mínima por un largo período de tiempo (actuación prolongada). La
clorhexidina es una molécula con carga positiva que se liga a la superficie
bacteriana (cargada negativamente), por la electrostática. Eso promueve la
adsorción de la clorhexidina en la superficie bacteriana.
La
acción antibacteriana ocurre en contra
un grande número de bacterias aerobias y anaerobias como, también, especies
Gram-positivas y Gram-negativas. La acción antimicrobiana puede ser
bacteriostática o bactericida. La acción bacteriostática ocurre cuando la
solución de clorhexidina es utilizada en pequeñas concentraciones y se debe a
la inhibición de síntesis de ATP de las bacterias. La acción bactericida, que
ocurre con las soluciones más concentradas, se da por la ruptura de la membrana
citoplasmática de eses microorganismos. Generalmente, las soluciones de
clorhexidina utilizadas en endodoncia son bactericidas.
La
clorhexidina puede ser utilizada en la terapia endodóntica con función
antibacteriana tanto en la preparación biomecánica de los conductos radiculares
cuanto en la fase medicamentosa. Sus indicaciones precisas serían los casos de
hipersensibilidad al hipoclorito de sodio y
rizogénesis incompleta debido a la relativa ausencia de toxicidad de esa
sustancia.
Los
atributos de las soluciones de clorhexidina la caracterizan como un artificio
complementar de la preparación biomecánica. Sus propiedades antibacterianas no
son mejores que las de las soluciones de hipoclorito de sodio además no poseer
las capacidades indispensables del hipoclorito de sodio como, por ejemplo, la
disolución tejidual y la acción blanqueadora. La característica complementar de
la clorhexidina se mantiene tratándose
de sus aplicaciones en la fase medicamentosa pues su acción antibacteriana no
es superior a la acción de las pastas de hidróxido de calcio conteniendo
paramonoclorofenol canforado. Algunos relatos en la literatura indican que la
clorhexidina posee una acción antibacteriana eficiente contra microorganismos
anaerobios frecuentemente presentes en las necrosis pulpares. La acción contra
anaerobios puede ser más efectiva que la acción del peróxido de hidrogeno, agua
de cal y del propio hipoclorito de sodio.
La
instabilidad e ineficiencia de la clorhexidina en pH menor que 5 y mayor que 8
no viabiliza la asociación de la clorhexidina con sustancias con pH extremo
tanto de carácter ácido cuanto básico como el hipoclorito de sodio cuyo pH es
generalmente mayor que 12 (Spanó, 1999)
excepto para el líquido de Dakin cuyo pH puede variar de 7 al 9.
Se
nota que la clorhexidina posee carácter complementario en la terapia
endodóntica. Sus principales indicaciones complementarias son los casos de
hipersensibilidad al hipoclorito de sodio por razones obvias; rizogénesis
imperfecta debido a la biocompatibilidad y en el tratamiento de las necrosis
pulpares por la acción antimicrobiana contra bacterias anaerobias. La
clorhexidina puede ser adquirida en farmacias de manipulación solicitándose la
solución acuosa de digluconato de clorhexidina en las concentraciones de 0,2 al
2,0 %, siendo que las soluciones más concentradas poseen acción antibacteriana
más efectiva.
Tensoactivos
Los
tensoactivos, también conocidos como detergentes, cuando disolvidos en agua, sufren una disociación
ionica en sus moléculas, que ejecutan movimientos brownianos.
Las
moléculas se distribuyen por toda la superficie del agua, saturándola. La
tensión superficial de los detergentes es baja por el hecho de haber equilibrio de fuerzas de repulsión
y atracción por el agua, que son dadas por las partes hidrófobas e hidrófilas
de las moléculas, respectivamente. Así, dada la baja tensión superficial, el detergente puede mojar rápidamente
toda la superficie a ser limpiada, siendo esto considerado como humectación.
La
humectación es la capacidad que una sustancia líquida posee de humedecer o
mojar una superficie sólida. Cuanto menor el tiempo de contacto necesario para
que un líquido humedezca un sólido, mayor será su poder humectante. Esa
característica es muy importante en los agentes tensoactivos, pues cuanto mayor
es su poder de humectación, más rápido será su acción.
Pécora
y cols. (1987) verificaron que los tensoactivos aniónicos presentan capacidad
de humectación más rápida que los tensoactivos catiónicos. Ellos han constatado
que los aniónicos (lauril sulfato de sodio y el Lauril dietilenoglicol éter sulfato de sodio) presentaban un
tiempo de humectación alrededor de 10 segundos en un hilo de algodón mientras
que el tiempo dispendido por los catiónicos era alrededor de 3 minutos.
Después
de la humectación, ocurrirá entonces el fenómeno de adsorción. Ello ocurrirá a
través de la unión de la parte hidrófoba, que también es lipófila, a la grasa
y, la parte hidrófila se liga al agua. Así, la cadena hidrocarbónica funciona
como una puente que tiene una de las extremidades la grasa y en la otra (grupo
polar) ligada al agua. Ese fenómeno ocurre hasta que haya el envolvimiento de
toda la partícula grasosa (oleosa), habiendo el movimiento de estas partículas
de las paredes las cuales estaban adheridas. Esto ocurre hasta que la
superficie se quede totalmente libre de la contaminación grasosa (oleosa) y
protegida por las moléculas del detergente fijadas a ella.
Después de
la adsorción, la partícula oleosa, no puede depositarse nuevamente sobre la superficie en que ella estaba.
Así, ella debe ser mantenida en suspensión, lo que acontece a través del
mecanismo de repulsión que ocurre entre las partículas oleosas que fueron
circundadas por el detergente y que
poseen, ahora, la misma carga ionica.
Se torna evidente, entonces, que la contaminación grasosa es fácilmente
removida durante los procedimientos operatorios, cuales sean, la preparación
biomecánica y la irrigación/aspiración.
La eficacia de la acción de un detergente se relaciona con algunos
factores, entre los cuales la agitación mecánica, la temperatura y su concentración.
La agitación mecánica es promovida
por la acción de los instrumentos endodónticos, aumentando la superficie de
contacto entre el detergente y la contaminación a ser removida.
Generalmente, los detergentes cuando calentados a la temperatura de
37ºC, tienen su acción mejorada debido al mayor número de partículas activas,
además que esta temperatura es biológicamente compatible.
La concentración de un detergente
debe quedar en un nivel dicho "óptimo", una vez que el aumento de la
concentración del detergente no aumenta el poder de limpieza de la solución.
![]() Detergentes
Aniónicos:
Detergentes
Aniónicos:
1-
Lauril sulfato de sodio: Es una mixtura de alquil sulfato de sodio, teniendo
como constituyente principal el lauril sulfato de sodio. Sus propiedades
surfactantes están en el ánion que es formado durante su ioniozación. Es
bastante soluble en el agua.
Haciendo parte de este grupo, tenemos el Texapon
K12, que según Nagen-Filho & Vieira Pinto (1970), tiene un comportamiento
semejante al Tergentol.
2- Lauril dietilenoglicol éter sulfato de sodio:
Este detergente diluido en agua (0,125%), recibe el nombre comercial de Tergentol,
siendo amplia-mente usado en Endodoncia. Su principio activo es lo mismo que o
detergente conocido como Duponol C (Tomasi y cols. 1970). Este tensoactivo fue pioneiramente usado en
Endodoncia por Paiva (1959), que preconizaba su uso durante el cambio de limas
en la biomecánica.
![]() Detergentes Catiónicos:
Detergentes Catiónicos:
1- Cloruro de benzalconio: Este tensoactivo es
encontrado con los siguientes nombres Cloruro de Zefiran, Zefirol, BTC, Roccal,
Benirol, Germitol, Drapolene, Cequartil, Germinol y otros (The Merck Index).
La solución de cloruro de benzalconio en la
proporción de 0,1% tiene alto poder bactericida y bacteriostático; bajo poder
inflamatorio; detergente con largo tiempo de vida (Shef-life); relativamente atóxico; no irritantes de membranas
mucosas o piel; prácticamente insípido e inodoro ( Accepted Dental Remedies,
1964).
Fue introducido por Filgueira y cols. (1962) como
solución irrigante de conductos radiculares.
2- Compuestos derivados del amonio cuaternario:
2.1 Dehyquart A -Ese tensoactivo es un cetil
trimetil amonio, que es de fácil adquisición, bajo costo, incolor, forma
líquida, soluble en agua, desinfectante y presenta pH neutro. Fue introducido
en la Endodoncia como solución irrigante de conductos radiculares por Kunelt
& Bertschinger (1976).
2.2 Cloruro de cetil piridina: Strindberg (1956)
introdujo ese tensoactivo catiónico como solución irrigante de conductos
radiculares, que recebió el nombre de fantasía de Biosept.
Según Engstron & Spangberg (1967), el Biosept
al 0,1% presentó biocompatibilidad aceptable.
2.3 Salvizol: Este tensoactivo fue introducido
como solución irrigante de conductos radiculares por Trotter (1956). Su
composición básica es el N,N-decametileno-bis-4 amino-quinaldio y tiene acción
quelante. Entre las propiedades de ese tensoactivo, debe ser destacado su amplio espectro de acción, siendo activo
sobre la mayoría de los microorganismos Gram-positivos y, fungicida (Spangberg
et al, 1978); poseyendo propiedades bactericidas mismo en presencia de materia
orgánica.
Los tensoactivos catiónicos Dehyquart A y Biosept
y, los tensoactivos aniónicos Lauril sulfato de sodio y el Lauril
dietilenoglicol éter sulfato de sodio fueron comparados cuanto a su capacidad
en promocionar limpieza de conductos radiculares por Fidel & Rothier
(1990). Esos autores han concluido que los tensoactivos estudiados no promovieron
conductos radiculares más limpios que el líquido de Dakin e, no había
diferencia estadística significante entre la capacidad de limpieza promocionada
por los tensoactivos estudiados.
![]() Detergentes
neutros:
Detergentes
neutros:
Ese
tensoactivo es un polisorbato y tiene solubilidad en el agua, alcohol, acetato
de etila y en aceites vegetales, pero es insoluble en aceites minerales. Son
agentes emulsionantes y tensoactivos. entre muchos polisorbatos, se puede
encontrar el Tween 80 y el Tween 20. Ellos son utilizados en medicina para
facilitar la difusión de medicamentos inyectables en los músculos. En la
Endodoncia, ese tensoactivo fue introducido por Paiva & Antoniazzi (1973)
como un de los componentes de la crema Endo-PTC.
Quelantes:
Para el tratamiento de conductos radiculares
angostos, Callahan (1894), propuso la utilización del ácido sulfúrico al 50%, y
este método perduró por muchos años. Buckley (1926) preconizaba el uso del
ácido fenolsul-fónico al 80% por ser menos irritante que el ácido sulfúrico.
Grossman
(1946) preconizaba el uso del ácido clorhídrico para sustituir el ácido
sulfúrico en la instrumentación de conductos angostos, pues ese ácido produce
en contacto con la dentina, el cloruro de calcio que es más soluble que el
sulfato de calcio, resultante de la acción del ácido sulfúrico.
Así,
hasta 1957, los endodoncistas usaban en la instrumentación de conductos
angostos ácidos fuertes corrosivos y altamente concentrados.
En
eses años, Nygaard Ostby, eminente profesor de Endodoncia de Noruega, propuso
el uso de un sal derivado de un ácido débil y orgánico, el etileno diamino
tetra acético sal disódico (EDTA), pues por
su acción quelante, permite formular una solución auxiliar para la
instrumentación de los conductos radiculares angostos. Esa solución, en la
concentración y en el pH indicado por el
autor es biológicamente compatible a los tejidos de la pulpa y
periápice.
La
solución propuesta por Ostby (1957), o sea, el EDTA tiene la siguiente fórmula:
EDTA sal disódico 17g, agua destilada 100 mL, NaOH 5N qsp para obtener pH 7,3.
Ostby
(1957) y Hill (1959) adicionaron el tensoactivo cetavlon (bromuro de
cetiltrimetilamonio) a la solución de EDTA, formando, así, una asociación
conocida como EDTAC.
![]() Ácido Cítrico:
Ácido Cítrico:
El ácido cítrico viene siendo empleado como solución auxiliar de la instrumentación de los conductos radiculares. Varios investigadores se han dedicado a estudiar esa solución y, entre ellos podemos citar Loel (1975), Wayman y cols. (1979), Pashley (1981), Brancini y cols. (1983), Pécora (1985).
Pécora (1985) observó que el ácido cítrico al 10%
promovía aumento de la permeabilidad dentinaria, pero menor que los promovidos
por las soluciones halogenadas y EDTA.
Savioli y cols. (1993), estudiaron
comparativamente la capacidad de limpieza del ácido cítrico en varias
concentraciones con la solución de Dakin. Ellos han constatado que la solución
de ácido cítrico al 10% promovía conductos radiculares tan limpios como los de
la solución de Dakin.
![]() Peróxidos:
Peróxidos:
1 - Peróxido de hidrogeno:
El peróxido de hidrogeno (H2O2) es un potente
agente oxidante. Es utilizado en Endodoncia hace mucho tiempo, pues libera el
oxigeno naciente. En el pasado, Callahan (1894) preconizaba esa solución como
irrigante final de los conductos radiculares después de haber sido sometido a
la acción del ácido sulfúrico neutralizado con el bicarbonato de sodio.
Abott (1918) preconizaba ese agente oxidante, en
la concentración del 30% como agente blanqueador de dientes oscurecidos. En esa
alta concentración, esa solución es aún hoy utilizada como agente blanqueador.
El peróxido de hidrogeno (agua oxigenado), cuando
en contacto con sangre produce reacción efervecente, liberando oxigeno naciente
produciendo hemólisis y hemoglobinólisis, removiendo detritos del interior del
conducto radicular. Como agente oxidante evita que la sangre penetre en los
canalículos dentinarios y altere el color de los dientes.
Actualmente, esa solución aún es utilizada como
solución irrigante alternada con el hipoclorito de sodio en la técnica de
Grossman (1943).
2 - Dióxido de sodio :
El dióxido de sodio es un peróxido con fórmula Na2O2
que en contacto con el agua forma el NaOH + H2O2 + O2.
Esta solución fue propuesta por Kirk (1893) para ser utilizado tanto como
agente blanqueador como agente irrigante de conductos radiculares. Esta
solución cayó en desuso.
3 - Peróxido de urea:
El peróxido de urea fue investigado por Blechman & Cohen (1951) y
propuesto como solución auxiliar de la instrumentación de conductos
radiculares. Ellos verificaron que el peróxido de urea es más efectivo que el peróxido de hidrogeno,
por que sus moléculas al entraren en contacto con pus y sangre, se rompió más
lentamente, liberando oxigeno naciente por más tiempo.
Las investigaciones con peróxido de urea
fueron desarrolladas en las décadas del
50 al 70 y esa solución fue introducida asociada a otras sustancias (RC-Prep y
Endo-PTC).
![]()
Las
asociaciones y mixturas son modos de
conseguirse llegar al máximo provecho de las propiedades químicas que
las soluciones presentan. Así, por ejemplo, cuando se mixtura un tensoactivo
con un agente quelante, se realiza la potencialización de este último por que
la tensión superficial del líquido es reducida favoreciendo el contacto del
agente quelante con las paredes de dentina del conducto radicular.
Todas
las mixturas o asociaciones visan, fundamentalmente, añadir efectos químicos de
las soluciones utilizadas.
En
Endodoncia existe la posibilidad de
prepararse varias mixturas y asociaciones y, muchas de ellas ya están
consagradas después de muchos años de uso y con mucha investigaciones ya
realizadas. Buscaremos, aquí, citar las más conocidas y estudiadas, pero, aún
muchas investigaciones deben ser hechas
. 1 -
Detergente anionico + Hipoclorito de sodio:
Leonardo
& Leal (1991) citan con mucha propiedad que la asociación de una solución
de Hipoclorito de sodio (4-6%) con el tensoactivo lauril dietilenoglicol éter
sulfato de sodio al 0,1% proporcionan, cuando utilizados como solución
irrigante de conductos radiculares en dientes despulpados y contaminados la
obtención de un 93,7% de culturas
negativas.
Esta
asociación es bastante lógica, una vez que los tensoactivos al reducir la
tensión superficial de las soluciones posibilitan que los hipocloritos entren
en contacto más íntimo con los microorganismos y restos pulpares necróticos,
facilitando su acción solvente, antimicrobiana, hemolítica, etc.
Esta
asociación puede ser preparada durante la produción directa de la solución de
Hipoclorito de sodio o posteriormente, con la adición de lauril dietilenoglicol
éter sulfato de sodio en la concentración de 0,1%, o sea, 1 mL por litro.
La
asociación fue estudiada por Pécora et al (1997), cuanto a su eficacia en
limpiar el conducto radicular y aumento de la permeabilidad dentinaria y, con
base en los resultados obtenidos se puede afirmar que la adición de, solamente,
0,1% de lauril dietilinoglicol éter sulfato de sodio al hipoclorito de sodio
reduce la tensión superficial y promueve aumento de la permeabilidad
dentinaria, en todas las concentraciones.
2 -
Detergente anionico + Nitrofurazona :
2.1
Esta mixtura fue introducida por Varella & Paiva (1969) y consiste en colocar 15 mL de Furacin (nitofurazona) en
200 mL de Tergentol (lauril dietilenoglicol éter sulfato de sodio al 0,125%).
Furacin y Tergentol son los nombre de fantasía, de los productos citados. Según
Zerlotti (1959), el Furacin (nitrofurazona) posee acción antimicrobiana mismo
en bajas concentraciones.
2.2 En
vez de utilizar el lauril
dietilenoglicol éter sul-fato de sodio como tensoactivo, Nagen-Filho &
Vieira-Pinto (1978) han asociado a la nitrofurazona el tensoactivo anionico
lauril sulfato de sodio ( Texapon K12).
Eses
dos tipos de tensoactivos anionicos son biológicamente compatibles y producen
lo mismo efecto.
El
lauril sulfato de sodio en solución acuosa presenta tensión superficial
ligeramente más baja que o lauril dietilenoglicol éter sulfato de sodio y tiene
capacidad de humectación más rápida ( Pécora et al, 1987).
3 -
Detergente Anionico + Hidróxido de calcio:
Esta
mixtura puede ser utilizada como solución irrigante de conductos radiculares,
presentando pH alcalino. La solución presenta tensión superficial baja
favoreciendo a la acción del hidróxido de calcio para entrar en contacto con as
paredes de los conductos radiculares. Ella también fue indicada para ser
utilizada para la limpieza de las cavidades.
En el mercado brasilero puede ser adquirida esa mixtura con los siguientes nombres de fantasía: Tergidrox y Irrigocal. Ella puede también ser aviada en el consultorio y para esto, basta adicionar 0,14 gramas de hidróxido de calcio en 100 mL de Tergentol. No embalar esa mixtura en recipiente de vidrio, pues el pH alcalino ataca el vidrio. Use, para esto, embalaje de plástico.
4 -
Detergente Anionico + EDTA:
Paiva &
Antoniazzi (1984) recomiendan que la solución de EDTA sea aviada a partir de
una solución de Tergentol, pues segundo esos autores, este producto facilita la
acción del EDTA, pues mejora su capacidad humectante.
5 -
Detergente cationico + EDTA (EDTAC):
Ostby
(1957) y Nill (1959) enfatizaron que la solución de EDTA debe ser asociada al
compuesto de amonio cuaternario denominado Cetavlon (bromuro de cetil trimetil
amonio). Esta asociación es conocida como EDTAC.
Zuolo
y cols. (1987) estudiaron el efecto de la solución de EDTA y de las
asociaciones EDTA + Tergentol, EDTA + cloruro de cetil piridino y EDTA +
cetavlon sobre la permeabilidad dentinaria radicular. Ellos observaron que la
más eficaz en promover aumento de esa permeabilidad fue la asociación EDTAC seguida
de la solución de EDTA.
Guimarães
y cols. (1987) observaron que la solución de EDTA presentava tensión
superficial de 69 dinas/cm y la adición de cetavlon al 0,1% para formar el
EDTAC, presentó una tensión superficial reducida en un 50%. Así, la asociación
EDTAC presentando baja tensión superficial posibilita mayor acción del EDTA.
Cruz-Filho
(1994) Estudió la acción de la solución del EDTAC sobre la micro dureza de la
dentina radicular, en diferentes tiempos de aplicación (00, 01, 02, 03, 05 07 y
10 minutos) y constató que la acción de este quelante se hace sentir en el
primero minuto de aplicación. Ese autor apunta que cuanto más tiempo la
solución de EDTA permanezca en contacto con la dentina, mayor será la reducción
de su micro dureza.
Fairbanks
(1995) investigó la acción de las asociaciones EDTAC, EDTA-T y EDTA sobre la
micro dureza del conducto radicular. Ha concluso que todas esas asociaciones
tienen efecto reductor sobre la micro dureza de la dentina, después de cinco
minutos de contacto, pero la asociación EDTAC fue la más efectiva.
Pécora
(1992), estudió el efecto de las soluciones de Dakin y de EDTA, aisladas,
alternadas y mixturadas, sobre la permeabilidad de la dentina radicular y
concluyó que las soluciones de Dakin usadas de modo alternado con la solución
de EDTA en la proporción de 1:1 promovían mayor aumento de la permeabilidad.
6-
Hipoclorito de sodio alternado con peróxido de hidrógeno:
Grossman
(1943) preconizo una técnica de irrigación del conducto radicular que consiste
em el uso alternado de una solución de hipoclorito de sodio al 5% (soda clorada
duplamente concentrada) con la solución de peróxido de hidrogeno al 3% (agua oxigenado 10v). La mixtura de estas
dos soluciones ocurre en el interior del conducto radicular. El encuentro de
esas soluciones, potencialmente oxidantes, produce una reacción efervecente y
exotérmica (Costa, 1986; Barbin et al 1995), con liberación de oxigeno
naciente.
Esta
reacción propuesta por Grossman debe ser realizada con la colocación de las
soluciones de modo alternado en el interior del conducto radicular. Así, se
inicia con la solución de Hipoclorito de sodio y en seguida se pone la solución
del peróxido de hidrógeno. Esta alternancia debe ser realizada durante toda la
biomecánica del conducto radicular, de modo que la ultima a utilizar debe ser
siempre la solución de hipoclorito de sodio. Esto debe ser observado
correctamente, para que se agote toda la reacción de efervecencia y evite
efectos desagradables al paciente.
Por raciocinio químico, podemos afirmar que la
reacción de Grossman ocurre con el hipoclorito de sodio en cualquier
concentración, cuando colocado en contacto con peróxido de hidrogeno. Por lo
tanto, esa reacción puede ser realizada tanto con soda clorada, solución de
Milton y de Dakin. Lo que ocurre, químicamente, durante esa mixtura es siempre
la misma cosa, o sea la liberación de oxigeno naciente, efervecencia y
exotermía, pues los productos iniciales tienen más energía concentrada que los
productos resultantes.
La técnica de irrigación propuesta por Grossman
resiste a las críticas por medio siglo de aplicación directa en Endodoncia.
7- Hipoclorito de sódio + Ácido cítrico:
Loel (1975) utilizó una asociación de ácido
cítrico e Hipoclorito de sodio para la instrumentación de conductos radiculares.
Él ponía, inicialmente, en el conducto radicular una solución de ácido cítrico
al 50% y la dejaba actuar por dos minutos y en seguida adicionaba una solución
de Hipoclorito de sodio al 5%. Durante el contacto de esas soluciones ocurre
una reacción de efervescencia. Es pertinente informar que esa técnica no fue
muy investigada.
8- Peróxido de urea + EDTA + Carbowax ( RC-PREP)
asociado al hipoclorito de sodio al 5%.
El peróxido de urea comenzó a ser estudiado por
Blechman & Cohen (1951) y Cobe (1960) preconizó la asociación de esa
sustancia con glicerina anhidra (Gly-oxide) para la instrumentación de los
conductos radiculares. Stewart y cols
(1969), aprovechando las características quelantes del EDTA y las propiedades
antisépticas del peróxido de urea, preconizaron una nueva técnica para la
irrigación de conductos radiculares, dónde se utilizaba una crema que era
introducida en el interior del conducto. Esa crema tiene la siguiente
composición: EDTA (15%), peróxido de urea (10%) y carbowax ( 75%). Después de la colocación de esa crema en el interior
del conducto radicular se adiciona una solución de hipoclorito de sodio al 5% y
se procede la instrumentación.
La reacción química del peróxido de urea con
hipoclorito de sodio produce una reacción de efervecencia, semejante a la
producida en la reacción de Grossman, con liberación del oxigeno naciente. La
adición de EDTA proporciona a esta asociación la acción quelante sobre el
calcio de las paredes de los conductos radiculares.
Pécora (1985) constató que el uso de la crema
RC-PREP con Hipoclorito de sodio al 5% promovía aumento de la permeabilidad
dentinaria de modo menos intenso que la
utilización de la solución de EDTA y de las soluciones halogenadas en las diferentes
concentraciones, cuando utilizadas individualmente.
9- Peróxido de urea + Tween 80 + Carbowax
(ENDO-PTC) neutralizado con solución de Dakin
Paiva & Antoniazzi (1973) modificaron la
fórmula propuesta por Stewart y cols.
(1969), substituyendo el EDTA por el Tween 80 en la crema y en el lugar
de usarse el Hipoclorito de sodio al
5%, ellos preconizaban la neutra-lización del peróxido de urea con el líquido
de Dakin. Es oportuno informar que la reacción química que se procesa durante
el uso de la propuesta de Stewart y cols. (1969) y Paiva & Antoniazzi
(1973) es la misma, la única diferencia es la intensidad de la reacción en
virtud de las concentraciones de las soluciones de hipoclorito de sodio
utilizadas.
En lo que se refiere a las asociaciones y mixturas muchas cosas todavía pueden y deben
ser investigadas, pues la ciencia solamente avanza delante de puntos de vista
divergentes. Las concordancias unánimes corresponden a estagnación y retroceso.
AUERBACH, M. B. Antibiotics vs instrumentation in endodontic. NY St Dent J., v. 19, n. 5, p. 225-8, 1953. BADAN, M. Oxigenoargentoterapia. Mogi-Mirim, Pacini & Piccolomini, 1949.
BARBIN, E. L.; SPANÓ, J. C. E.; SILVA, R. S.; PÉCORA, J. D. Análise "in vitro" da variação térmica durante o uso do hipoclorito de sódio, em diferentes concentrações, com peróxido de hidrogênio a 3%. Rev. Odontol. Univ. São Paulo, v. 9, n. 3, p. 189-192, jul./set. 1995.
BARBIN, E. L. Estudo "in vitro" do efeito da adição de lauril dietilenoglicol éter sulfato de sódio nas soluções de hipoclorito de sódio sobre suas Propriedades físico-químicas anteriores e posteriores à dissolução do tecido pulpar bovino. Ribeirão Preto, 1999, 108p. Dissertação (Mestrado) - Faculdade de Odontologia de Ribeirão Preto, Universidade de São Paulo.
BRANCINI, M.R.; BRAMANE, C.M.; BERBERT, A.
Poder de limpeza de algumas soluções irrigadoras analisadas pela microscopia de
varredura. Rev. Paul. Endodont. 4 (1/14): 116-23, jan./dez., 1983
CALLAHAN,
J.R. Sulguric acid for opening root-canals. Dent. Cosmos, n. 36, v. 12, p.
957-59, 1894.
COBE, S.
Investigations of a new dental chemotherapeutic agent in presence of blood.
Oral Surg., v. 13, n. 1, p. 678-85, 1960.
COHEN, S; STEWART, G.G.; LASTER, L.L. The effects of acids, al.kal.ies, and chelating agents on dentine permeability. Oral. Surg., 29(4):631-634, Apr. 1970.
COSTA, W. F.; WATANABE, I.; ANTONIAZZI, J.H.; PÉCORA, J.D.; NUTI-SOBRINHO, A.; LIMA, S.M.N.: Estudo comparativo através do M.E.V. da limpeza de canais radiculares quando da instrumentação manual e ultrasônica. Rev. Paul. Odont., 9(6): 10-23, nov./dez., 1986.
COSTA, W.F. Avaliação da elevação da temperatura produzida pela reação exotérmica de algumas associações de substâncias químicas utilizadas no preparo do canal radicular. Ribeirão Preto, 1987. 147p. Tese (Livre Docência) - Faculdade de Odontologea de Ribirão Preto, Universidade de São Paulo.
COSTA, W.F.; ANTONIAZZI, J.H.; CAMPOS, M.N.M.; PÉCORA, J.D.; ROBAZZA, C.R.C.: Avaliação comparativa sob microscopia ótica, da capacidade de limpeza da irrigação manual convencional versus ultrasônica dos canais radiculares. Rev. Paul. Odont., 8(5): 50-60, set./out., 1986.
COSTA, W.F.; ANTONIAZZI, J.H.; PÉCORA, J.D.: Avaliação da instrumentação ultrasônica na limpeza dos canais radiculares quando realizado no comprimento de trabalho e aquém do comprimento do trabalho, 1995 (no prelo)
CRUZ FILHO, A. M. Ação do EDTAC sobre a microdureza da dentina radicular, após diferentes tempos de aplicação. 1994, 86 p. Tese de Mestrado. Faculdade de Odontologia de Ribeirão Preto da USP.
DAKIN, H.D. In the use of certain antiseptic substances in the treatment of infected wounds. Br. Med. J., (2):318-320, Aug. 1915.
FAIRBANKS, D. C. O. Avaliação da capacidade quelante do EDTA, do EDTAC e do EDTA-T pela análise da microdureza da dentina radicular. Rio de Janeiro, 1995, 82 p. Tese de Mestrado. Faculdade de Odontologia da Universidade Estdual do Rio de Janeiro - UERJ.
GROSSMAN,
L.I. Irrigation of root canal.s. J. Amer. Dent. Assoc., 30(12):1915-1917, Dec.
1943.
GROSSMAN, L.I.; MEINAM, B.W. Solution of pulp tissue by chemical. agents. J. Amer. Dent. Assoc., 28(2):223-225, Feb. 1941.
GUIMARAES, L.F.L.; ROBAZZA, C.R.C.; MURGEL,
C.A.F.; PECORA, J.D. Tensão superficial. de al.gumas soluções irrigantes dos
canais radiculares. Rev. Odont. USP, 2(1):6-9, jan./mar., 1988.
HAND,R.E.;
SMITH, M.L.; HARRISON, J.W. Anal.ysis of the effect of dilution on the necrotic
tissue dissolution property of sodium hypochlorite. J. Endodontics, 4(4):60-64,
1978.
INGLE, J. I.
and ZELDOW, B. J. An evaluation of mechanical instrumentation and the negative
culture in endodontic therapy. J.A.D.A., v. 50, p. 471, 1958.
KIRK, E.C. Sodium Peroxid, a new dental. bleaching agent an antiseptic. Dental. Cosmos, 35(2):192-198, Feb. 1893.
LEONARDO, M. R. Contribuição para o estudo dos efeitos da biomecânica e da medicação tópica na desinfecção dos canais radiculares. (Tese). Araraquara, SP, Brasil, 1965.
LEONARDO, M.R.; LEAL., J.M. Endodontia:
Tratamento dos canais radiculares. 2 Ed. Panamericana, São Paulo,
1991.
LOEL, D.A.:
Use of acid cleaser in endodontic therapy. J. Amer. dent. Assoc. 90(1): 148-51
Jan., 1975
MARCHESAN, M.A.; SOUZA, R.A.;
GUERISOLI, D.M.Z.; SILVA, R.S.; PÉCORA, J.D. Análise
de algumas propriedades físico-químicas das águas sanitárias encontradas no
mercado brasileiro. Rev. Bras. Odontol. 55(50): 301-3, 1998.
McCOMB, D.;
SMITH, D.C. A preliminary scanning electron microscopic study of root canal.
after endodontic procedures. J Endodontics, 1(7):238-242, July, 1975.
MOODNIK,
R.M.; DORN, S.O.; FELDMAN, M.J.; LEVEY, M.; BORDEN, B.G. Efficacy of
biomechanical. instrumentation: a scanning electron microscopic study. J
Endodontics, 2(9): 261-266, Sept. 1976.
MOORER,
W.R.; WESSELINK, P.R. Factors promoting the tissue dissolving capability of
sodium hypochlorite. Int. Endod. J. 15(4):186-187, 1982.
NICHOLLS, E. The efficacy of cleasing of the root canal. Br. Dent. J., 112(2):167-170, Feb. 1962.
PAIVA, J.G.: Irrigação e aspiração em Endodontia. R.G.O., 7 (4): 162, jul./agost. 1959.
PAIVA, J.G.; ANTONIAZZI, J.H. O uso de uma associação de peróxido de uréia e detergente (Tween 80) no preparo químico-mecânico dos canais radiculares. Rev. Assoc. Paul. Cir. Dent.,27(7):416-422, dez., 1973.
PÉCORA, J.D. Contribuição ao estudo da permeabilidade dentinária radicular. Apresentação de um método histoquímico e análise morfométrica. Ribeirão Preto, 1985, 110p.Dissertação de Mestrado. Faculdade de Odontologia de Ribeirão preto da USP.
PÉCORA, J.D. Efeito das soluções de Dakin e de EDTA, isoladas, al.ternadas e misturadas, sobre a permeabilidade da dentina radicular. Ribeirão Preto, 1993, 148p Tese de Livre-Docente. Faculdade de Odontologia de Ribeirão Preto, USP.
PÉCORA, J.D. Estudo da permeabilidade dentinária do assoal.ho da câmara pulpar dos molares inferiores humanos, com raízes separadas. Ribeirão Preto, 1990, 117p. Tese de Doutorado. Faculdade de Odontologia de Ribeirão Preto da USP.
PÉCORA, J.D.; GUIMARÃES, L.F.; SAVIOLI, R.N. Surface tension of several. drugs used in endodontics. Braz. Dent. J. 2(2):123-129 1992.
ROBAZZA, C.R.C. Contribuição ao estudo"in vitro" da permeabilidade dentinária radicular quando do emprego de al.gumas substâncias de uso endodôntico. Ribeirão preto, 1973, 92p. Tese de Doutorado Faculdade de Odontologia de Ribeirão Preto, USP.
SAVIOLI, R.N.; COSTA, W.F.; SAQUY, P.C.;
ANTONIAZZI, J.H.; PÉCORA, J.D.: Estudo comparativo entre o hipoclorito de sódio
e o ácido cítrico na capacidade de limpeza do canal radicular. Rev. Odonto USP, 7 (4):
273-7, out./dez., 1993.
SCHREIER, E. The treatment of infected root-canals wity kalium and natrium. Dent. Cosmos, v. 35, n. 9, p. 863-69, 1893.
SANTOS, T.C. ESTUDO "IN VITRO" DO EFEITO DO AUMENTO DA TEMPERATURA DAS SOLUÇÕES DE HIPOCLORITO DE SÓDIO SOBRE SUAS PROPRIEDADES FÍSICO-QUÍMICAS ANTERIORES E POSTERIORES À DISSOLUÇÃO DO TECIDO PULPAR BOVINO. Ribeirão Preto, 1999, 108p. Dissertação (Mestrado) - Faculdade de Odontologia de Ribeirão Preto, Universidade de São Paulo.
SENIA, S.E.;
MARSHALL, J.F. & ROSEN, S. The solvent action of sodium hypochlorite on
pulp of extracted teeth. Oral Surg., 31(1):96-103, Jan. 1971.
SHIH, S.E.; MARSHALL, J.F.; ROSEN, S.: The bactericidal efficiency of sodium hypochlorite as an endodontic irrigant. Oral Surg., 29(4): 613-19, April 1970.
SPANO, J.C.E. Estudo "in vitro" das propriedades físico-químicas das soluções de hipoclorito de sódio, em diferentes concentrações, antes e após a dissolução de tecido pulpar bovino. Ribeirão Preto, 1999, 96p. Dissertação (Mestrado) - Faculdade de Odontologia de Ribeirão Preto, Universidade de São Paulo.
STEWART, G.
G. The importance of chemomechanical preparation of root canal. Oral Surg., v.
8, n. 9, p. 993-97, 1955.
STEWART, G.
G.; COBE, H. M.; RAPPAPORT, H. A study of a new medicament in chemomichanical
preparation of infected root canals. J. Amer. Dent. Ass., v. 63, n. 1, p. 33-7,
1961.
STEWART,
G.G.; KAPSIMAL.S,P.; RAPPAPORT, H. EDTA and urea peroxide for root canal.
preparation. J. Am. Dent. Assoc. 78 (2):335-338,1969.
TREPAGNIER,
C.M.; MADDEN, R.M. & LAZZARI, E.P. Quantitative study of sodium
hypochlorite as an in vitro endodontic irrigant. J. Endod., 3(5):194-196, May,
1977.
TUCKER, J.W.; MIZRAHI,S.; SELTZER, S. Scanning electron microscopic study of efficacy of various irrigating solutions: urea, tubulicid red and tubulicid blue. J. Endodontics, 2(3):71-77, Mar. 1976.
VARELLA, J.A.F. & PAIVA, J.G.: Manual de Endodontia. 2 Ed., São Paulo, Atheneu, 1969. 226p.
VIANNA, M. M. A soda clorada e as culturas negativas. Rev. Gaucha Odontol., v. 15, n. 2, p. 43-6, 1967.
WAL.KER,
R.E. A definite and dependable therapy for pulpless teeth. J. Amer. Dent. Assoc.
23(2):1418-1425, aug. 1936.
WITTGOW, W. C.; SABISTON, C. B. Jr. Microorganisms from pulpal chambers of intact teeth eith necrotic pulps. J. Endodon., v. 1, n. 5, p. 168-71, 1975.
ZUOLO, M; MURGEL, C.A.F.; PÉCORA,J.D.; ANTONIAZZI,J.H.;COSTA, W.F. Ação do EDTA e suas associações com tensoativos na permeabilidade da dentina radicular. Rev. Odont. USP 1(4):18-23, out./dez. 1987.
![]()
GRACIAS POR SU VISITA
Volver a las
páginas de Temas en Endodoncia
Lab. Endodoncia | Disciplina de Endodoncia | Ir a la página
de Métodos de Investigación |
Departamento de Odontología Restauradora | FORP-USP | USP | Web Masters
![]()
Esta página
fue elaborada con el apoyo del Programa Incentivo a la Producción de Material
Didáctico del SIAE, Pró-Rectorías de Graduación y Post-Grado de la USP.
