
SOLUÇÕES AUXILIARES DA BIOMECÂNICA
DOS CANAIS RADICULARES
ENDODONTICS - ENDODONCIA

Professor Titular de Endodontia FORP-USP
![]()
PREPARO BIOMECÂNICO DOS CANAIS RADICULARES
![]()
Preparo Biomeânico dos Canais Radiculares
Os termos preparo mecânico, preparo químico-mecânico, instrumentação, limpeza e forma, biomecânica são utilizados indistintamente em Odontologia, apesar de que na II Convenção Internacional de Endodontia realizado na Universidade de Pensilvania, Filadélfia, USA em 1953 estabeleceu-se como correto o termo BIOMECÂNICA dos canais radiculares. O termo biomecânica é justificado porque esse ato operatório é realizado com princípios e exigências biológicas.
Callahan (1894), Grossman (1943, 1960) Stewart (1955), Ingle & Zeldow (1958) e Nicholls (1962) apresentaram etapas ou seqüências do tratamento endodôntico que, fundamentalmente, consistem na instrumentação ou alargamento do canal radicular, sua desinfecção e obturação. Para esses autores não há etapa mais importante que a outra. Todas estão correlacionadas e qualquer descuido em uma delas poderá provocar o insucesso do tratamento endodôntico.
Autores como Auerbach (1953), Stewart (1955), Vella (1955) consideram o preparo biomecânico como sendo a fase mais importante do tratamento endodôntico. Leonardo (1991), com base em inúmeros trabalhos científicos, compartilha da idéia do relevante papel do preparo biomecânico dos canais radiculares.
Existe um axioma em Endodontia, cuja afimação é atribuída a Sachs, citado por Schilder (1982) e Leonardo & Leal (1991) que diz: "O Mais importante na terapia dos canais radiculares é o que se retira do seu interior e não o que nele se põe". É claro que este axioma não pretende minimizar a importância das outras fases do tratamento endodôntico. A verdade é que a obturação dos canais radiculares não pode ser conseguida sem que os mesmos tenham sido preparado adequadamente para receber o material obturador.
O preparo biomecânico é realizado por meio da instrumentação manual e/ou mecânica do canal radicular utilizando alargadores, limas e brocas associados com soluções irrigantes que apresentem propriedades químicas mais específicas para cada caso em particular. Desse modo, a biomecânica dos canais radiculares poderia ser melhor entendida como preparo bioquímico-mecânico dos canais radiculares. Leonardo & Leal (1991) citam as seguintes finalidades do preparo biomecânico:
Finalidades do Preparo Biomecânico nas Pulpectomias:
Combater a possível infecção superficial da polpa.
Remover a polpa coronária e radicular, restos pulpares, sangue infiltrados nos canalículos dentinários.
Prevenir o escurecimento dental.
Retificar, o mais possível, as curvaturas do canal radicular.
Preparar o batente apical (degrau apical).
Alargar e alisar as paredes do canal dentinário, dando-lhe conformação cônica e preparando-o para receber a obturação.
Remover raspas de dentina e o "smear layer" produzido durante a instrumentação do canal radicular.
Preservar a vitalidade do coto pulpar, ramificações laterais, secundárias e acessórias.
Finalidades do Preparo Biomecânico nas Necropulpectomias
Neutralizar o conteúdo tóxico da cavidade pulpar.
Remover por meio mecânico e químico os microrganismos e seus produtos, reduzindo a microbiota do canal radicular.
Remover restos necróticos, dentina infectada e amolecida. Alargar e alisar as paredes dentinárias do canal radicular, dando-lhe forma cônica.
Retificar o mais possível as curvaturas do canal radicular. Remover raspas de dentina e "smear layer" e permitir maior contato dos materiais obturadores com as paredes dentinárias do canal radicular.
O preparo biomecânico, para a sua execução, utiliza os seguintes meios:
1º Mecânico - ação dos instrumentos no canal radicular, aplicação de técnicas de instrumentação.
2º Físico - consiste no ato de irrigar e aspirar uma solução irrigante - movimento hidráulico.
3º Químico - ação química das soluções irrigantes.
Os meios químicos e físicos são auxiliares do mecânico. O meio físico compreende a movimentação hidráulica de um líqüido circulante - irrigação/asperação. O meio químico corresponde à ação das propriedades químicas que as soluções irrigantes apresentam. Essas propriedades químicas dão às soluções irrigantes a qualidade de auxiliar, pois elas atuaram no interior do canal radicular como anti-sépticas, solventes de tecidos, quer orgânico como inorgânico, mudam o pH do meio, e etc.
Assim, a escolha de uma solução irrigante não é aleatória. Ela deve estar relacionada com o caso em questão, para se obter melhor resultado quanto à limpeza e desinfecção. É muito importante que o profissional saiba as propriedades químicas das soluções irrigantes para selecioná-la e utilizá-la da melhor maneira possível, em cada caso em particular.
![]()
Os meios químicos utilizados no preparo biomecânico dos canais radiculares se dão pelas soluções irrigantes dos canais radiculares. Dentre essas soluções auxiliares da instrumentação endodôntica, as mais comumente empregadas em Endodontia são os compostos halogenados, tensoativos, quelantes, ácidos e peróxidos além de associações e/ou misturas dessas substâncias.
![]() 1
- Compostos Halogenados:
1
- Compostos Halogenados:
1.1 Soluções de hipoclorito de sódio (NaOCl) em diferentes concentrações de cloro ativo:
NaOCl a 5% (soda clorada)
NaOCl a 2,5% (solução de Labaraque)
NaOCl a 2 a 2,5% (água sanitária)
NaOCl a 1%
NaOCl a 0,5%
1.2 NaOCl a 1% com 16% de cloreto de sódio ( Solução de Milton)
1.3 NaOCl a 0,5% com ácido bórico para reduzir o pH (Solução de Dakin)
1.4 NaOCl a 0,5% com bicarbonato de sódio para reduzir o pH (Solução de Dausfrene)
1.5 Clorexidina
![]() 2
- Tensoativos :
2
- Tensoativos :
2.1 Tensoativos Aniônicos
Os tensoativos aniônicos são compostos nos quais a cadeia graxa hidrófóbica está anexado a um grupo hidrófilo carregado negativamente.
2.1.1 Lauril sulfato de sódio (Texapon)
2.1.2 Lauril dietileno glicol éter sulfato de sódio
A solução aquosa de Lauril dietileno glicol éter sulfato de sódio a 0,125% leva o nome de Tergentol.
2.2 Tensoativos Catiônicos :
Os tensoativos catiônicos são compostos que apresentam o grupo polar ou "cabeça" com carga positiva.
2.2.1 Cetavlon (brometo de cetiltrimetilamônio)
O Cetavlon é adicionado nas soluções de EDTA-C com a finalidade de redução do potencial hidrogeniônico (pH).
2.2.2 Dehyquart A (cloreto de cetiltrimetilamônio)
2.2.3 Biosept (cloreto cetil piridino)
2.2.4 Zefirol (cloreto de benzalcônio)
2.3 Tensoativos Neutros:
Os tensoativos neutros ou não iônicos são compostos nos quais a cadeia graxa hidrofóbica esta anexada a um grupo hidrófilo sem carga.
2.3.1 - Tween 80
![]() 3
- Quelantes:
3
- Quelantes:
3.1 EDTA
3.2 Salvizol (tensoativo quelante)
![]() 4
- Ácidos:
4
- Ácidos:
4.1 Ácido Cítrico
![]() 5
- Peróxidos:
5
- Peróxidos:
5.1 Peróxido de hidrogênio
5.2 Peróxido de uréia
![]() 6
- Associações e/ou misturas:
6
- Associações e/ou misturas:
6.1 - Detergente aniônico + hipoclorito de sódio
6.2 - Detergente aniônico + nitrofurazona ( Tergen-tol/Furacin)
6.3 - Detergente aniônico + Hidróxido de cálcio (Irrigocal e Tergidrox)
6.4 - Detergente aniônico + EDTA (Paiva & Antoniazzi 1984)
6.5 - Hipoclorito de sódio alternado com peróxido de hidrogênio (Reação de Grossaman 1943).
6.6 - Hipoclorito de sódio + ácido cítrico (Loel 1975)
6.7 - Detergente catiônico + EDTA = EDTAC
6.8 - Peróxido de uréia + EDTA + Carbowax (RC-PREP) neutralizado com hipoclorito de sódio a 5%, Stewart et al 1969
6.9 - Peróxido de uréia + Tween 80 + Carbowax neutralizado com hipoclorito de sódio ( Solução de Dakin ). Paiva & Antoniazzi 1973.
![]() 7
- Outras Soluções:
7
- Outras Soluções:
7.1 - Água destilada
7.2 - Soro Fisiológico
7.3 - Solução de Hidróxido de Cálcio a 0,14%
![]()
Os compostos halogenados são assim chamados por possuírem elementos químicos em sua moléculas pertencentes ao grupo dos Halogêneos da tabela periódica. O elemento químico cloro, por exemplo, faz parte do grupo dos Halogêneos. O uso dos compostos halogenados iniciou-se em 1792 quando produziu-se, pela primeira vez, uma solução contendo íons hipoclorito que recebeu o nome de Água de Javele. Esse hipoclorito constituia-se de uma mistura de hipoclorito de sódio e potássio.
Em 1820, Labaraque, químico francês, obteve o hipoclorito de sódio com 2,5% de cloro ativo e essa solução passou a ser utilizada com anti-septicos de feridas. Em 1915, Dakin, químico americano, durante a Primeira Guerra Mundial, com base em pesquisa propôs uma nova solução de hipoclorito de sódio a 0,5% de cloro ativo neutralizado com ácido bórico. Essa nova solução ficou conhecida com o nome do autor - Solução de Dakin. Dakin (1915) observou que ao tratar feridas de guerra com hipoclorito de sódio a 2,5% (Solução de Labaraque), obtinha-se anti-sepsia, porém a cicatrização da ferida era demorada. Para verificar o que ocorria, ele diluiu a solução até a concentração de 0,5% de cloro ativo e utilizou-a com a mesma finalidade. Suas observações puderam constatar que nesta concentração obtinha-se o mesmo resultado, ou seja, anti-sepsia da ferida no entando a cicatrização era lenta. Ele observou que a demora de cicatrização era devido ao grande teor de hidróxido de sódio presentes nas soluções de hipoclorito, independente de sua concentração. Com base neste raciocínio, Dakin neutralizou a solução de hipoclorito de sódio a 0,5% cujo pH era 11 com ácido bórico (0,4%). Isto possibilitou uma solução de hipoclorito de sódio com pH próximo do neutro. Desse modo, com o uso de uma solução de hipoclorito de sódio com pH próximo do neutro conseguiu-se desinfecção das feridas sem o efeito indesejável da ação das hidroxilas sobre os tecidos vivos.
Ele verificou que o hipoclorito de sódio, quer a 2,5% ou a 0,5% apresentava pH extremamente próximos em virtude das hidroxilas livres. Com a adição do ácido bórico ocorria a formação do borato de sódio na solução, evitando assim a presença de hidroxilas livres irritantes dos tecidos. É bom frisar e deixar bastante claro que a solução de Dakin é uma solução de hipoclorito de sódio neutralizada com ácido bórico. Quando se utiliza uma solução de hipoclorito de sódio a 0,5%, não significa necessariamente que se está usando a solução proposta por Dakin.
A solução de hipoclorito de sódio com pH elevado, em torno de 11 a 12, é mais estável e a liberação de cloro é mais lenta. Á medida que se reduz o pH da solução, quer por meio do ácido bórico ou do bicarbonato de sódio (Solução de Dausfrene), a solução fica muito instável e a perda de cloro é mais rápida. Isto significa que o tempo de vida útil da solução é pequena.
A luz solar e a temperatura elevada provoca a liberação de cloro deixando a solução ineficaz. Pécora et al (1986 e 1987) estudaram o "shelf life" (tempo de vida) da solução de Dakin armazenadas em vidro âmbar em diversas condições de temperatura, ou seja, à luz solar, à sombra em temperatura ambiente e, isento de luz em geladeira à 9 graus centígrados. Eles observaram que após 4 meses a solução perdia 80% de seu teor de cloro quando exposta à luz solar, 60% à temperatura ambiente e, apenas 20% quando conservada a baixa temperatura e isenta de luz. Esses autores, também, verificaram que apenas 30% das marcas comerciais testadas apresentavam teor de cloro dentro das especificações, ou seja, acima de 0,4%.
Quando uma solução de hipoclorito de sódio apresenta teor de cloro abaixo de 0,3% ela não é efetiva contra candida albicans e aos estreptococus faecalis. Em concentração de 0,5% elas são efetivas contra esses microrganismos em um tempo de ação de 15 segundos (Monteiro-Souza et al, 1992).
Desse modo, deve-se ressaltar a importância de se conhecer a concentração do hipoclorito de sódio que se vai utilizar na terapêutica endodôntica para se obter as reais vantagens que essas soluções podem oferecer quanto a limpeza e desinfecção.
Em laboratórios, utiliza-se o método da titulometria pelo iodo para se aferir a concentração de cloro ativo das soluções de hipoclorito de sódio. A titulometria, no entanto, é muito problemática para ser utilizada em um consultório odontológico em virtude das soluções e vidrarias necessárias. Assim, para se conhecer de modo rápido, prático e econômico e com relativa precisão pode-se utilizar o método da volumetria apresentado por Paiva et al (1989). O método da volumetria pode ser realizado em qualquer consultório e necessita dos seguintes materiais: duas seringas luer (uma de 10 ml e outra de 3ml), uma agulha, detergente de cozinha e água oxigenada a 3%. O "Modus operandi" é o que segue: a seringa Luer de 10 ml deve ser transformada em um tubo de ensaio, despresando o êmbolo e fechando o local de colocação da agulha. Em seu interior deve-se colocar 1 ml de água oxigenada e três a quatro gotas de detergente. A seguir, coloca-se 2,8 ml da solução de hipoclorito de sódio a ser testado. Após isto, agite o tubo e deixe-o em repouso por um minuto. Após isto, mede-se a coluna de espuma formada por meio de uma régua. O resultado obtido, em centímetros, deve ser dividido por dez e tem-se, desse modo, o teor de cloro ativo aproximado da solução testada. A verificação do teor de cloro ativo é importante, pois o odontólogo não deve utilizar produto fora da especificação, pois o resultado da terapêutica endodôntica pode ficar comprometido.
As soluções de hipoclorito de sódio tiveram, sempre boa aceitação como solução irrigante de canais radiculares e Walker (1936) apresentou sua técnica de irrigação que consistia no uso do hipoclorito de sódio a 5% como solução auxiliar da instrumentação. Com base nas observações de Walker (1936), Grossman & Meinam (1941) realizaram um estudo para verificar a capacidade de solvência de tecidos orgânicos das soluções irrigantes utilizadas até aquela época. Eles colocaram polpas nas seguintes soluções: dióxido de sódio (Kirk, 1893), ácido sulfúrico (Callahan, 1894), Papaina (Halarn, 1900), hipoclorito de sódio (Walker, 1936). Após os experimentos, esses autores concluíram que o hipoclorito de sódio a 5% (soda clorada) era capaz de dissolver tecido pulpar mais rapidamente que qualquer das soluções testadas.
A seguir, em 1943, Grossman propôs um técnica de irrigação de canais radiculares que resiste à crítica por cinqüenta anos e consiste em uso alternado de uma solução de hipoclorito de sódio a 5% com o peróxido de hidrogênio a 3% (10 volumes). Nessa técnica, a irrigação começa e termina com a solução de hipoclorito de sódio a fim de evitar a liberação tardia de oxigênio nascente, ou seja, após o curativo entre sessões. A reação química entre as soluções de hipoclorito de sódio e peróxido de hidrogênio libera oxigênio nascente, é efervescente e exotérmica . A exotermia desta reação química foi demonstrada por COSTA em 1986 e Barbin et al. (1995). O oxigênio nascente gerado dentro do sistema de canais radiculares é importante para a ação anti-septica contra microrganismos anaeróbios. AUERBACH (1953) comparou, por meio de testes bacteriológicos, a eficácia da técnica de irrigação proposta por Grossman (1943), obtendo alta porcentagens de testes negativos imediatamente após a instrumentação.
A capacidade da solução de hipoclorito de sódio em dissolver tecidos orgânicos foi estudada por diversos pesquisadores, dos quais podemos citar: Senia (1971), Hand et al (1978), Cunninghan & Balakejan (1980), Abou-Rass et al (1981), Spanó (1999), Santos (1999) e Barbin (1999).
Spanó (1999) testou a capacidade solvente das soluções de hipoclorito de sódio nas concentrações de 0,5 - 1,0 - 2,5 e 5,0% em polpas bovinas e observou que a capacidade solvente é diretamente proporcional à concentração da solução de hipoclorito de sódio, ou seja, quanto maior a concentração dessa solução tanto maior será a capacidade solvente.
Santos (1999) avaliou a capacidade solvente em polpas bovinas das soluções de hipoclorito de sódio segundo a variação de temperatura. Constatou-se que a capacidade solvente é diretamente proporcional à temperatura, isto é, quanto maior a temperatura da solução de hipoclorito de sódio tanto maior será sua capacidade solvente.
Barbin (1999) estudou a capacidade solvente das soluções de hipoclorito de sódio aditivadas com tensoativo (lauril dietilenoglicol éter sulfato de sódio) observando que a adição de tensoativos diminuia a capacidade solvente das soluções de hipoclorito de sódio.
O hipoclorito de sódio não existe no estado de pó mas somente em solução aquosa. Estando em solução aquosa, encontra-se em um equilíbrio químico dinâmico, onde pode apresentar-se como um sal não-dissociado, dando origem a outras substâncias ou apresentando-se também totalmente dissociado. Essa solução aquosa de hipoclorito de sódio, devido ao seu equilíbrio químico dinâmico, pode ser representada pela seguinte reação química:
NaOCl + H2O <==> NaOH + HOCl <==> Na+ + OH- + H+ + OCl- ==> O2 + Cl2 (Reação I)
As reações químicas entre os componentes do tecido pulpar e as substâncias presentes na solução de hipoclorito de sódio podem responsáveis pelo processo de dissolução tecidual podem ser vistas a seguir:
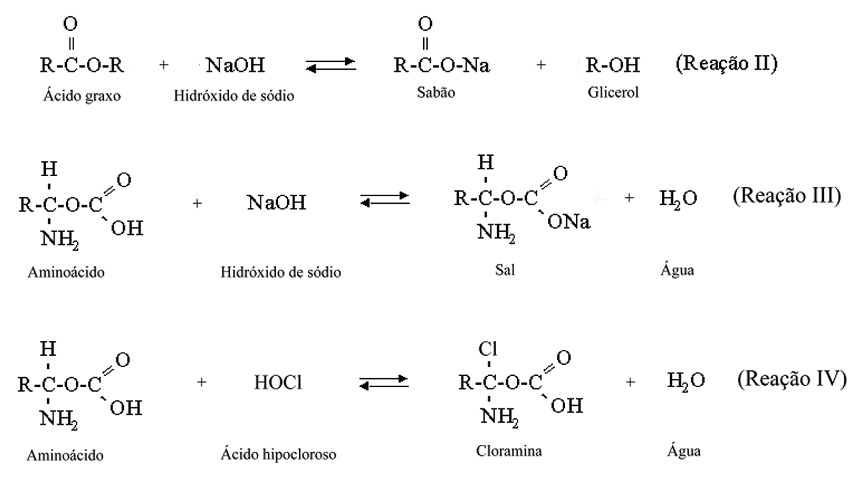
Pela análise ou interpretação das reações I a IV pode-se entender as ações do hipoclorito de sódio:
O hidróxido de sódio é um potente solvente orgânico e de gordura formando sabões (saponificação).
O ácido hipocloroso é um potente agente antimicrobiano por liberar cloro nascente que se combina com o grupo amina das proteínas, formando as cloraminas. O ácido hipocloroso (HOCl) sofre decomposição pela ação da luz, do ar e do calor liberando cloro livre e, em secundariamente oxigênio nascente.
Neutraliza produtos tóxicos - atua sobre as proteinas.
Bactericida, libera cloro e oxigênio nascente.
pH alcalino - Neutraliza a acidez do meio, tornando-o impróprio para o desenvolvimento bacteriano.
Desidrata e solubiliza proteinas, transformando-as em matériais facilmente elimináveis.
Não irrita os tecidos vivos (solução de Dakin) e os hipoclorito de sódio mais concentrados podem e devem ser usados em dentes necrosados com e sem lesões periapicais.
Agente clareador - potente fonte de agente oxidante.
Agente desodorizante por atuar sobre produtor em decomposição.
A dissolução do tecido pulpar pelo hipoclorito de sódio é fundamental pois o campo operatório na endodontia é composto por um sistema de canais radiculares sendo que boa parte desse sistema é inacessível aos instrumentos endodônticos. A dissolução do tecido acaba por ajudar na limpeza endodôntica pela transformação de substâncias insolúveis (tecido pulpar e restos necróticos) em substâncias solúveis como os sabões, cloraminas e sais de aminoácidos além da ação dos sabões produzidos na reação que mantém corpos gordurosos em suspensão (micelas) passíveis de serem aspirados. A capacidade de limpeza dos canais radiculares proporcionada pelo uso de soluções de hipoclorito de sódio foi investigada por McComb et al (1975), Tucker et al (1976), Moodnik et al (1976), Crabb (1982), Yamada et al (1983), Costa et al (1986), dentre outros. O hipoclorito de sódio nas mais diferentes concentrações possibilitam evidenciar maior aumento da permeabilidade dentinária e este fato foi constatado por vários pesquisadores dentre eles Robazza (1973) e Pecora (1985 e 1990).
As pesquisas de Spanó (1999), Santos (1999) e Barbin (1999) também avaliavam o potencial hidrogeniônico, a condutividade iônica, a tensão superficial e os teores de cloro antes e após o processo de dissolução pulpar. O estudo dessas propriedades físico-químicas levaram a interessantes constatações, tais como: o processo de dissolução pulpar consome íons hidroxila o que assinala a ocorrência da reação de saponificação de gorduras; houve redução da quantidade de íons após a dissolução o que indica a formação de compostos moleculares como as cloraminas (que possuem ação anti-septica; ocorre redução da tensão superficial apos a dissolução o que demonstra a ocorrência de reação de saponificação entre o hipoclorito de sódio e o tecido pulpar; e a quantidade de cloro livre diminui após a dissolução o que assinala a participação e/ou liberação do cloro livre durante a reação de dissolução pulpar.
Santos (1999) notou que a quantidade de cloro livre nas soluções utilizadas em temperaturas maiores após a dissolução era muito reduzida indicando uma participação ativa dessa substância no processo de dissolução e/ou uma liberação maciça de cloro dentro dos canais radiculares o que promoveria ação anti-septica.
Barbin (1999) observou que as soluções de hipoclorito de sódio aditivadas com tensoativo sofriam aumento da tensão superficial após a dissolução tecidual o que relaciona a piora na capacidade solvente pela adição de tensoantivo com a diminuição da reação de saponificação. Sabe-se que antes da dissolução pulpar, a solução de hipoclorito de sódio possui tensão superficial pouco menor que a da água (Guimarães et al., 1987 e Pécora et al., 1992).
As atividades do ácido hipocloroso dependem do pH. Em meio ácido ou neutro predomina a forma ácida não dissociada (instável e mais ativo , HOCl). Em meio alcalino prevalece a forma iônica dissociada (estável e menos ativa). Por esse motivo o "shelf-life" das soluções de hipoclorito de sódio com pH elevado é mais estável e as de pH próximo do neutro (solução de Dakin) tem vida útil muito pequena. O líqüido de Dakin apresenta hipoclorito de sódio neutralizado com ácido bórico apresenta grande quantidade de ácido hipocloroso devido ao seguinte processo químico:
3NaOCl + H3BO3 ==> Na3BO3 + 3HOCl
Portanto, nas soluções de hipocloritos de sódio não neutrazilados têm-se maior concentração de hidróxido de sódio (NaOH) e menor de ácido hipocloroso (HOCL) e nos hipocloritos neutralizados têm-se o inverso, ou seja, menor quantidade NaOH e maior de HOCl.
Moorer & Wessenlink (1992), verificaram os fatores que influenciam a capacidade da solução de hipoclorito de sódio em dissolver tecido orgânico. Eles constataram que o princípio ativo dessa solução depende das moléculas de ácido hipocloroso (HOCl). No entanto, Spano (1999), Santos (1999) e Barbin (1999) em contraste com Moorer & Wessenlink (1992), responsabilizam a ação conjunto do hidróxido de sódio com o ácio hipocloroso pela dissolução pulpar pois ambos são consumidos na interação hipoclorito de sódio com a matéria orgânica. Os autores concluíram que o poder da solução de hipoclorito de sódio em dissolver tecido orgânico depende, fortemente, dos seguintes fatores:
Quantidade de matéria orgânica e hipoclorito presente;
Freqüência e intensidade de fluxo irrigante e,
Superfície de contato entre o tecido e solução de hipoclorito de sódio.
Por esse motivo, a irrigação de canais com hipoclorito de sódio, nas várias concentrações, deve ser abundante para se obter o máximo de efeito.
Leonardo & Leal (1991) indicam, em seu livro, o uso do hipoclorito de sódio ( 4-6%) para:
Neutralizar produtos tóxicos com a função de possibilitar a penetração cirúrgica imediata aos canais radiculares em dentes com reação periapical crônica evidenciável radiograficamente.
Como coadjuvante do preparo biomecâmico dos canais radiculares de dentes despolpados e infectados, em função de sua ação bactericida.
Durante a remoção de obturações parciais do canal radicular.
Em casos do uso da técnica de Grossman (1943) e Stewart et al (1969).
Continuando, esses autores indicam o uso do hipoclorito de sódio a 0,5% (solução de Dakin) e a 1% (solução de Milton) para a neutralização do conteúdo séptico pulpar, em casos de tratamento endodôntico de dentes despolpados e/ou infectados sem periapicopatia evidenciável radiograficamente.
A biocompatibilidade das soluções de hipoclorito de sódio está inversamente relacionada com sua concentração, ou seja, quanto menor a concentração tanto maior a biocompatibilidade dos hipocloritos de sódio. Essa propriedade recebeu especial atenção de Spangberg et al (1973), Nery et al(1974), Wennberg (1980) e Rosa et al (1975).
A escolha da concentração do hipoclorito de sódio a ser utilizada flutua entre a biocompatibilidade das menores concentrações e a eficiência das maiores concentrações. Essa busca passa pela certeza da existência de cloro ativo na solução que depende de vários fatores envolvidos na distribuição comercial desse produto.
As indicações da utilização das soluções de hipoclorito de sódio nas diferentes concentrações, variam de escola para escola. Nos Estados Unidos, Schilder (1982) relatou que o hipoclorito de sódio é a solução irrigadora mais importante para a limpeza e desinfecção dos canais radiculares. O uso do hipoclorito de sódio nas concentrações de 0,5 e 1% foi e continua sendo utilizada em medicina a mais de 75 anos.
No Brasil, o clima quente e as características de distribuição e armazenamento dos produtos odontológicos nos estabelecimentos comerciais causam o problema da utilização da solução de hipoclorito de sódio com o teor de cloro ativo menor do que o necessário. Isso se deve à instabilidade das soluções de hipoclorito de sódio que é agravada pelo calor do clima, pelo tempo de armazenamento na prateleira comercial das lojas especializadas em Odontologia e até pelo embalamento em frascos inadequados (o frasco adequado deve ser de cor ambar ou opaco). Essa conjectura provocou a procura de uma solução comercial de hipoclorito de sódio com teor de cloro confiável, de fácil acesso e financeiramente acessível. O produto que atende a esses requisitos é a água sanitária, hipoclorito de sódio na concentração de 2 a 2,5 %.
Marchesam et al. (1998) avaliaram algumas propriedades físico-químicas das águas sanitárias encontradas no mercado brasileiro e observaram que todas elas apresentavam concentração de cloro livre dentro do anunciado pelo fabricante (entre 2 e 2,5 %). A análise das propriedades físico-quimicas pH, condutividade iônica e teor de cloro ativo mostraram também enorme semelhança entre elas. Esses achados autorizaram a utilização da água sanitária como solução auxiliar da biomecânica dos canais radiculares. Embora não tenha sido encontrada partículas de sujeira nas águas sanitárias estudadas poder-se-ia filtrar a solução antes de sua utilização por meio de funil e filtro de papel ou chumaço de algodão. Cabe salientar que alguns cuidados devem ser observados quando da compra e utilização da água sanitária para utilização na terapêutica endodôntica, como, por exemplo: não utilizar água sanitária com corantes ou essências odoríferas e não empregar o mesmo frascos de água sanitária tanto para serviços gerais quanto para terapia endodôntica para salvaguardar a biosegurança.
As águas sanitárias por terem concentração entre 2 e 2,5 % são muito efetivas mas podem provocar irritabilidade tecidual e comprometimento do coto pulpar e ramificações laterais, secundárias e acessórias em pulpectomias. Isso levou a Marchesam et al. (1998) a procurarem um fator de diluição, ou seja, uma forma simples de diluição da água sanitária com a finalidade de se obter uma solução de hipoclorito de sódio com a concentração aproximada de 1,0%. Independentemente da marca comercial, a diluição da água sanitária para uma concentração de 1,0% pode ser feita facilmente no consultório adicionando-se 5 partes do produto à 2 partes de água de abastecimento filtrada (água potável). Recomenda-se filtrar o produto com um chumaço de algodão ou filtro de papel para eliminar possíveis impurezas. Cumpre informar que águas sanitárias com corantes ou perfumadas não devem ser utilizadas. Deve-se aguardar um período de 30 minutos após a diluição para a utilização da solução de hipoclorito de sódio a 1,0% na prática clínica. O embalamento dessa solução necessitará ser feito em recipiente que impeça a passagem de luz (vidro ambar o plástico opaco) e o armazenamento, em local fresco e fora do alcance da luz solar. A geladeira seria a melhor opção de armazenamento (PÉCORA et al. 1987) mas a solução deve estar na temperatura ambiente para a terapêutica.
Como já foi salientado, as soluções de hipoclorito de sódio, em diferentes concentrações, são as mais utilizadas como soluções auxiliares da instrumentação de canais radiculares e novos comentários sobre elas serão realizados durante o tópico das associações e misturas.
A clorexidina pode ser considerada um compoto halogenado uma vez que contém cloro em sua molécula. O cloro pertence, na tabela periódica, à família dos halogêneos. Na Odontologia, a clorexida é usualmente utilizada em solução aquosa de 0,2 a 2,0%. Essas soluções são incolores e inodoras, mais estáveis em pH de 5 a 8, tendo a maior eficiência antibacteriana na faixa de pH de 5,5 a 7. O soluto mais comum das soluções de clorexidina é o sal digluconato de clorexidina.
A clorexidina possui ação antimibacteriana de amplo espectro e apresenta substantividade, ou seja, se liga à superfície do esmalte e dentina como também às glicoproteínas e, a medida que a concentração dessa substância no meio cai, ela se desloca para esse meio de forma a manter uma concentação mínima por um longo período de tempo (atuação prolongada). A clorexidina é uma molécula com carga positiva que se liga à superfície bacteriana carregada negativamente por ação eletrostática. Isso promove a adsorção da clorexidina na superfície bacteriana.
A ação antibacteriana ocorre contra um grande número de bactérias aeróbias e anaeróbias como, também, espécies Gram-positivas e Gram-megativas. A ação antimicrobiana pode ser bacteriostática ou bactericida. A ação bacteriostática ocorre quando a solução de clorexidina é utilizada em pequenas concentrações e se deve à inibição da síntese de ATP das bactérias. A ação bactericida, que ocorre com as soluções mais concentradas, se dá pela ruptura da membrana citoplasmática desses microrganismos. Geralmente, as soluções de clorexidina utilizadas na endodontia são bactericidas.
A clorexidina pode ser utilizada na terapia endodôntica com função antimibacteriana tanto no preparo biomecânico dos canais radiculares quanto na fase medicamentosa. Suas indicações precisas seriam os casos de hipersensibilidade ao hipoclorito de sódio e rizogênese imcompleta devido a relativa ausência de toxicidade dessa substância.
Os atributos das soluções de clorexidina caracterisam-na como um artifício complementar do preparo biomecânico. Suas propriedades antibacterianas não são melhores que as das soluções de hipoclorito de sódio além de não possuir as capacidades indispenáveis do hipoclorito de sódio como, por exemplo, a dissolução tecidual e a ação clareadora. A característica complementar da clorexidina se mantém em se tratando de suas aplicações na fase medicamentosa pois sua ação antibacteriana não é superior a ação das pastas de hidróxido de cálcio contendo paramonoclorofenol canforado. Alguns relatos na literatura indicam que a clorexidina possui uma ação antibacteriana eficiente contra microrganismos anaeróbios freqüentemente presentes nas necroses pulpares. A ação contra anaeróbios pode ser mais efetiva que a ação do peróxido de hidrogênio, água de cal e do próprio hipoclorito de sódio.
A instabilidade e ineficiência da clorexidina em pH menor que 5 e maior que 8 inviabiliza a associação da clorexidina com substâncias com pH extremo tanto de caráter ácido quanto básico como o hipoclorito de sódio cujo pH é geralmente maior que 12 (Spanó, 1999) exceto para o líquido de Dakin cujo pH pode variar de 7 a 9.
Percebe-se que a clorexidina possui carater complementar na terapia endodôntica. Suas principais indicações complementares são os casos de hipersensibilidade ao hipoclorito de sódio por razões óbvias; rizogênese imperfeita devido à biocompatibilidade e no tratamento das necroses pulpares pela ação antimicrobiana contra bactérias anaeróbias. A clorexidina pode ser adquirida em fármácias de manipulação solicitando-se a solução aqüosa de digluconato de clorexidina nas concentrações de 0,2 a 2,0 %, sendo que as soluções mais concentradas pussuem ação antibacteriana mais efetiva.
Os tenso ativos, também conhecidos como detergentes, quando dissolvidos em água, sofre uma dissociação iônica de suas moléculas, que executam movimentos brawnianos.
As moléculas se distribuem por toda a superfície da água, saturando-a. A tensão superficial dos detergentes é baixa pelo fato de haver equilíbrio de forças de repulsão e atração pela água, que são dadas pelas partes hidrófobas e hidrófilas das moléculas, respectivamente. Assim, dada a sua baixa tensão superficial, o detergente pode molhar rapidamente toda a superfície a ser limpa, sendo isto considerada como umectação.
A umectação é a capacidade que uma substância líqüida possue de umedecer ou molhar uma superfície sólida. Quanto menor o tempo de contacto necessário para que um líqüido umedeça um sólido, maior será seu poder umectante. Essa caracteristica é muito importante nos agentes tensoativos, pois quanto maior for seu poder de umectância, mais rápido será sua ação.
Pécora et al (1987) verificaram que os tensoativos aniônicos apresentam capacidade de umectação mais rápida que os tensoativos catiônicos. Eles constataram que os aniônicos (lauril sulfato de sódio e o Lauril dietilenoglicol éter sulfato de sódio) apresentavam um tempo de umectação entorno de 10 segundos em um fio de algodão, enquanto que o tempo gasto pelos catiônicos era ao redor de 3 minutos.
Após a umectação, ocorrerá então o fenômeno de adsorção. Ele ocorrerá através da união da parte hidrófoba, que também é lipófila, à gordura e, a parte hidrófila liga-se a água. Assim, a cadeia hidrocarbônica funciona como uma ponte que tem uma das extremidades a gordura e na outra ( grupo polar) ligada a água. Esse fenômeno ocorre até que haja o envolvimento de toda a partícula gordurosa (oleosa), havendo o deslocamento desta partículas das paredes as quais estavam aderidas. Isto ocorre até que a superfície fique totalmente livre da contaminação gordurosa (oleosa) e protegida pelas moléculas do detergente fixadas a ela.
A partícula oleosa, após a adsorção, não pode se depositar novamente sobre a superfície a que ela estava. Assim, ela deve ser mantida em suspensão, o que acontece através do mecanismo de repulsão que ocorre entre as partículas oleosas que foram circundadas pelo detergente e que possuem, agora, a mesma carga iônica.
Torna-se evidente, então, que a contaminação gordurosa é facilmente removida durante os procedi-mentos operatórios, quais sejam, o preparo biomecânico e a irrigação/aspiração.
A eficácia da ação de um detergente relaciona-se com alguns fatores, dentre os quais a agitação mecânica, a temperatura e a sua concentração.
A agitação mecânica é promovida pela ação dos instrumentos endodônticos, aumentando a super-fície de contato entre o detergente e a contaminação a ser removida.
Geralmente, os detergentes quando aquecidos à temperatura de 37ºC, tem sua ação melhorada devido ao maior número de partículas ativas, além desta temperatura ser biológicamente compatível.
A concentração de um detergente deve ficar num nível dito "ótimo", uma vez que o aumento da concentração do detergente não aumento o poder de limpeza da solução.
![]() Detergentes
Aniônicos:
Detergentes
Aniônicos:
1- Lauril sulfato de sódio: É uma mistura de alquil sulfato de sódio, tendo como constituinte principal o lauril sulfato de sódio. Suas propriedades surfactantes estão no ânion que é fornado durante sua ioniozação. É bastante solúvel em água.
Fazendo parte deste grupo, temos o Texapon K12, que segundo Nagen-Filho & Vieira Pinto (1970), tem um comportamento semelhante ao Tergentol.
2- Lauril dietilenoglicol éter sulfato de sódio: Este detergente diluido em água (0,125%), recebe o nome comercial de Tergentol, sendo ampla-mente usado em Endodontia. Seu princípio ativo é o mesmo que o detergente conhecido como Duponol C (Tomasi et al,1970). Esse tensoativo foi pioneiramente usado em Endodontia por Paiva (1959), que preconizava seu uso durante a mudança de limas na biomecânica.
![]() Detergentes
Catiônicos:
Detergentes
Catiônicos:
1- Cloreto de benzalcônio: Esse tensoativo é encontrado com os seguintes nomes Cloreto de Zefiran, Zefirol, BTC, Roccal, Beni-rol, Germitol, Drapolene, Cequartil, Germinol e outros (The Merck Index).
A solução de cloreto de benzalcônio na proporção de 0,1% tem alto poder bactericida e bacteriostático; baixo poder inflamatório; detergente com longo tempo de vida (Shef-life); relativamente atóxico; não irritantes de membranas mucosas ou pele; praticamente insípido e inodoro ( Accepted Dental Remedies, 1964).
Foi introduzido por Filgueira et al (1962) como solução irrigantes de canais radiculares.
2- Compostos derivados do amônio quaternário:
2.1 Dehyquart A Esse tensoativo é um cetil trimetil amônio, que é de fácil aquisição, baixo custo, incolor, forma líqüida, solúvel em água, desinfectante e apresenta pH neutro. Foi introduzido na Endodontia como solução irrigante de canais radiculares por Kunelt & Bertschinger (1976).
2.2 Cloreto de cetil piridina: Strindberg (1956) introduziu esse tensoativo catiônico como solução irrigante de canais radiculares, que recebeu o nome de fantasia de Biosept.
Segundo Engstron & Spangberg (1967), o Biosept a 0,1% apresentou biocompatibilidade aceitável.
2.3 Salvizol: Esse tensoativo foi introduzido como solução irrigante de canais radiculares por Trotter (1956). Sua composição básica é o N,N-decametileno-bis-4 amino-quinaldio e tem ação quelante. Dentre as propriedades desse tensoativo, deve ser salientado o seu amplo espectro de ação, sendo ativo sobre a maioria dos microrganismos gram + e, fungicida (Spangberg et al, 1978); possuindo propriedades bactericidas mesmo em presença de matéria orgânica.
Os tensoativos catiônicos Dehyquart A e Biosept e, os tensoativos aniônicos Lauril sulfato de sódio e o Lauril dietilenoglicol éter sulfato de sódio foram comparados quanto a suas capacidade de promoverem limpeza de canais radiculares por Fidel & Rothier (1990). Esses autores concluíram que os tenso-ativos estudados não promoveram canais radiculares mais limpos que o líqüido de Dakin e, não havia diferença estatistica significante entre a capacidade de limpeza promovida pelos tensoativos estudados.
![]() Detergentes
neutros:
Detergentes
neutros:
Esse tensoativo é um polisorbato e tem solubilidade em água, alcool, acetato de etila e em óleos vegetais e, insolúvel em óleos minerais. São agentes emulsionantes e tensoativos. entre muitos polisobato, pode-se encontrar o Tween 80 e o Tween 20. Ele são utilizados em medicina para facilitar a difusão de medi-camentos injetáveis nos músculos. Na Endodontia, esse tensoativo foi introduzido por Paiva & Antoniazzi (1973) como um dos componentes do creme Endo-PTC.
![]()
Para tratamento de canais radiculares atresiados, Callahan (1894), propôs a utilização do ácido sulfúrico a 50%, e este método perdurou por muitos anos. Buckley (1926) preconizava o uso do ácido fenolsul-fônico a 80% por ser menos irritante que o ácido sulfúrico.
Grossman (1946) preconizava o uso do ácido clorídrico para substituir o ácido sulfúrico na instru-mentação de canais atrésicos, pois esse ácido produz em contato com a dentina, o cloreto de cálcio que é mais solúvel que o sulfato de cálcio, resultante da ação do ácido sulfúrico.
Assim, até 1957, os endodontistas usavam na instrumentação de canais atrésicos ácidos fortes corrosivos e altamente concentrados.
Nesse anos, Nygaard Ostby, eminente professor de Endodontia da Noruega, propôs o uso de um sal derivado de um ácido fraco e orgânico, o etileno diamino tetra acético sal dissódico (EDTA), pois pela sua ação quelante, permite formular uma solução auxiliar para a instrumentação dos canais radiculares atresiados. Essa solução, na concentração e no pH indicado pelo o autor é biológicamente compatível aos tecidos da polpa e periápice.
A solução proposta por Ostby (1957), ou seja, o EDTA tem a seguinte fórmula: EDTA sal dissódico 17g, água destilada 100 ml, NaOH 5N qsp para obter pH 7,3.
Ostby (1957) e Hill (1959) adicionaram o tensoativo cetavlon (brometo de cetiltrimetilamônio) à solução de EDTA, formando, assim, uma associação conhecida como EDTAC.
![]() Ácido
Cítrico:
Ácido
Cítrico:
O ácido cítrico vem sendo empregado como solução auxiliar da instrumentação dos canais radiculares. Vários pesquisadores tem-se dedicado a estudar essa solução e, entre eles podemos citar Loel (1975), Wayman et al (1979), Pashley (1981), Brancini et al (1983), Pécora (1985).
Pécora (1985) observou que o ácido cítrico a 10% promovia aumento da permeabilidade dentinária, porém menor que os promovidos pelas soluções halogenadas e EDTA.
Savioli et al (1993), estudaram comparativamente a capacidade de limpeza do ácido cítrico em vá-rias concentrações com a solução de Dakin. eles constararam que a solução de ácido cítrico a 10% promovia canal radicular tão limpo como a solução de Dakin.
![]() Peróxidos:
Peróxidos:
1 - Peróxido de hidrogênio:
O peróxido de hidrogênio (H2O2) é um potente agente oxidante. É utilizado em Endodontia há muito tempo, pois libera oxigênio nascente. No passado, Callahan (1894) preconizava essa solução como irrigante final dos canais radiculares após ter sido submetido à ação do ácido sulfúrico neutralizado com o bicarbonato de sódio.
Abott (1918) preconizava esse agente oxidante, na concentração de 30% como agente clareador de dentes escurecidos. Nessa alta concentração, essa solução é ainda hoje utilizada como agente clareador.
O peróxido de hidrogênio (água oxigenada), quando em contato com sangue produz reação efervescente, liberando oxigênio nascente produzindo hemólise e hemoglobinólise, removendo detritos do interior do canal radicular. Como agente oxidante evita que o sangue penetre nos canalículos dentinários e altere a cor dos dentes.
Atualmente, essa solução ainda é utilizada como solução irrigante alternada com o hipoclorito de sódio na técnica de Grossman (1943).
2 - Dióxido de sódio :
O dióxido de sódio é um peróxido com fórmula Na2O2 que em contato com água forma o NaOH + H2O2 + O2. Esta solução foi proposta por Kirk (1893) para ser utilizado tanto como agente clarea-dor como agente irrigante de canal radicular. Esta solução caiu em desuso.
3 - Peróxido de uréia:
O peróxido de uréia foi pesquisado por Blechman & Cohen (1951) e proposto como solução auxiliar da instrumentação de canais radiculares. Eles verificaram que o peróxido de uréia é mais efetivo que o peróxido de hidrogênio, porque suas moléculas ao entrarem em contato com pús e sangue, rompe-se mais lentamente, liberando oxigênio nascente por mais tempo.
As pesquisas com peróxido de uréia foram desenvolvidas nas décadas de 50 a 70 e essa solução foi introduzidas associadas à outras substâncias (RC-Prep e Endo-PTC).
![]()
As associações e misturas são modos de se conseguir tirar o máximo proveito das propriedades químicas que as soluções apresentam. Assim, por exemplo, quando se mistura um tensoativo com um agente quelante, realiza-se a potencialização deste último porque a tensão superfícial do líqüido é reduzida favorecendo o contato do agente quelante com as paredes de dentina do canal radicular.
Todas as misturas ou associações visam, fundamentalmente, somar efeitos químicos das soluções utilizadas.
Na Endodontia existem a possibilidade de se preparar várias misturas e associações e, muitas delas já estão consagradas após muitos anos de uso e com muita pesquisa realizadas. Procuraremos, aqui, citar as mais conhecidas e estudas, mas, ainda muitas pesquisas devem ser feitas
. 1 - Detergente aniômico + Hipoclorito de sódio:
Leonardo & Leal (1991) citam com muita propriedade que a associação de uma solução de Hipoclo-rito de sódio (4-6%) com o tensoativo lauril dietilenoglicol éter sulfato de sódio a 0,1% proporcionam, quando utilizados como solução irrigantes de canais radiculares em dentes despolpados e contaminados a obtenção de 93,7% de culturas negativas.
Essa associação é bastante lógica, uma vez que os tensoativos ao reduzirem a tensão superficial das soluções possibilitam que os hipocloritos entre em contato mais íntimo com os microrganismos e restos pulpares necróticos, facilitando sua ação solvente, antimicrobiana, hemolítica, etc.
Essa associação pode ser preparada durante a produção direta da solução de Hipoclorito de sódio ou posteriormente, com a adição de lauril dietilenoglicol éter sulfato de sódio na concentração de 0,1%, ou seja, um ml por litro.
Este tipo de associação está sendo estudado por Pécora et al (1997), quanto a sua eficácia em limpar o canal radicular e aumento da permeabilidade dentinária e, com base nos resultados obtidos pode-se afirmar que a adição de, somente, 0,1% de lauril dietilinoglicol éter sulfato de sódio ao hipoclorito de sódio reduz a tenção superficial e promove aumento da permeabilidade dentinária, em todas as concentrações.
2 - Detergente aniônico + Nitrofurazona :
2.1 Essa mistura foi introduzida por Varella & Paiva (1969) e consiste em se colocar 15 ml de Furacin (nitofurazona) em 200 ml de Tergentol (lauril dietilenoglicol éter sulfato de sódio a 0,125%). Furacin e Tergentol é nome de fantasia, dos produtos citados. Segundo Zerlotti (1959), o Furacin (nitrofurazona) possui ação antimicrobiana mesmo em baixas concentrações.
2.2 Em vez de se utilizar o lauril dietilenoglicol éter sul-fato de sódio como tensoativo, Nagen-Filho & Vieira-Pinto (1978) associaram à nitrofurazona o tensoativo aniônico lauril sulfato de sódio ( Texapon K12).
Esses dois tipos de tensoativos aniônicos são biológicamente compatíveis e produzem o mesmo efeito.
O lauril sulfato de sódio em solução aguosa apresenta tensão superficial ligeiramente mais baixo que o lauril dietilenoglicol éter sulfato de sódio e tem capacidade de umectação mais rápida ( Pécora et al, 1987).
3 - Detergente Aniônico + Hidróxido de cálcio:
Esta mistura pode ser utilizada como solução irrigante de canais radiculares, apresentando pH alcalino. A solução apresenta tensão superficial baixa favorecendo a ação do hidróxido de cálcio para entrar em contacto com as paredes dos canais radiculares. Ela também foi indicada para ser utilizada no toalete das cavidades.
No mercado brasileiro pode ser adquirida essa mistura com os seguintes nomes de fantasia: Tergidrox e Irrigocal. Ela pode tambem ser aviada no consultório e para isto, basta adicionar 0,14 gramas de hidróxido de cálcio em 100 ml de Tergentol. Não embalar essa mistura em recipiente de vidro, pois o pH alcalino ataca o vidro. Use, para isto, embalagem de plástico.
4 - Detergente Aniônico + EDTA:
Paiva & Antoniazzi (1984) recomendam que a solução de EDTA seja aviado a partir de uma solução de Tergentol, pois segundo esses autores, esse produto facilita a ação do EDTA, pois melhora sua capacidade umectante.
5 - Detergente catiônico + EDTA (EDTAC):
Ostby (1957) e Nill (1959) enfatizaram que a solução de EDTA deve ser associado ao composto de amônio quaternário denominado Cetavlon (brometo de cetil trimetil amônio). Esta associação é conhecida como EDTAC.
Zuolo et al (1987) estudaram o efeito da solução de EDTA e das associações EDTA + Tergentol, EDTA + cloreto cetil piridino e EDTA + cetavlon sobre a permeabilidade dentinária radicular. Eles observaram que o mais eficaz em promover aumento dessa permeabilidade foi a associação EDTAC seguida da solução de EDTA.
Guimarães et al (1987) observaram que a solução de EDTA apresentava tensão superficial de 69 dinas/cm e a adição de cetavlon a 0,1% para forma o EDTAC, apresentou uma tensão superficial reduzida em 50%. Assim, a associação EDTAC apresentando baixa tensão superficial possibilita maior ação do EDTA.
Cruz-Filho (1994) Estudou a ação da solução de EDTAC sobre a microdureza da dentina radicular, em diferentes tempos de aolicação (00, 01, 02, 03, 05 07 e 10 minutos) e constatou que a ação deste quelante faz-se sentir no primeiro minuto de aplicação. Esse autor salienta que quanto mais tempo a solução de EDTA permanecer em contato com a dentina, maior será a redução de sua microdureza.
Fairbanks (1995) pesquisou a ação das associações EDTAC, EDTA-T e EDTA sobre a microdureza do canal radicular. Concluiu que todas essas associações tem efeito redutor sobre a microdureza da dentina, após cinco minutos de contato, porém a associação EDTAC foi a mais efetiva.
Pécora (1992), estuou o efeito das soluções de Dakin e de EDTA, isoladas, alternadas e misturadas, sobre a permeabilidade da dentina radicular e concluiu que as soluções de Dakin usadas de modo alternado com a solução de EDTA na proporção de 1:1 promovia maior aumento da permeabilidade.
6- Hipoclorito de sódio alternado com peróxido de hidrogênio:
Grossman (1943) preconizou uma técnica de irrigação do canal radicular que consiste no uso alternado de uma solução de hipoclorito de sódio a 5% (soda clorada duplamente concentrada) com a solução de peróxido de hidrogênio a 3% (água oxigenada 10v). A mistura dessas duas soluções ocorre no interior do canal radicular. o encontro dessas soluções, potencialmente oxidantes, produz uma reação efervescente e exotérmica (Costa, 1986; Barbin et al 1995), com liberação de oxigênio nascente.
Essa reação proposta por Grossman deve ser realizada com a colocação dessas soluções de modo alternado no interior do canal radicular. Assim, inicia-se com a solução de Hipoclorito de sódio e em seguida coloca-se a solução de peróxido de hidrogênio. Essa alternancia deve ser realizada durante toda a biomecânica do canal radicular, de modo a ultima a ser utilizada deve ser sempre a solução de hipoclorito de sódio. Isto deve ser observado corretamente, para que se esgote toda a reação de efervescência e evite efeitos desagradáveis ao paciente.
Por raciocínio químico, podemos afirmar que a reação de Grossman ocorre com o hipoclorito de sódio em qualquer concentração, quando colocado em contato com peróxido de hidrogênio. Portanto, essa reação pode ser realizada tanto com soda clorada, solução de Milton e de Dakin. O que ocorre, quimicamente, durante essa mistura é sempre a mesma coisa, ou seja a liberação de oxigênio nascente, efervescência e exotermia, pois os produtos iniciais tem mais energia con-centrada que os produtos resultantes.
A técnica de irrigação proposta por Grossman resiste às críticas por meio século de aplicação direta em Endodontia.
7- Hipoclorito de sódio + Ácido cítrico:
Loel (1975) utilizou uma associação de ácido cítrico e Hipoclorito de sódio para a instrumentação de canais radiculares. Ele colocava, inicialmente, no canal radicular uma solução de ácido cítrico a 50% e deixava-a atuar por dois minutos e em seguida adicionava uma solução de Hipoclorito de sódio a 5%. Durante o contato dessas soluções ocorre uma reação de efervescência. cumpre informar que essa técnica não foi muito pesquisada.
8- Peróxido de uréia + EDTA + Carbowax ( RC-PREP) associado ao hipoclorito de sódio a 5%.
O peróxido de uréia começou a ser estudado por Blechman & Cohen (1951) e Cobe (1960) preconizou a associação dessa substância com glicerina anidra (Gly-oxide) para a instrumentação dos canais radiculares. Stewart et al (1969) aproveitando as características quelante do EDTA e as propriedades antissépticas do peróxido de uréia, preconizaram uma nova técnica para a irrigação de canais radiculares, onde se utilizava um creme que era introduzido no interior do canal. Esse creme tem a seguinte composição: EDTA 15%, peróxido de uréia, 10% e carbowax 75%. Após a colocação desse creme no interior do canal radicular adiciona-se uma solução de Hipoclorito de sódio a 5% e procede a instrumentação.
A reação química do peróxido de uréia com hipoclorito de sódio produz uma reação de efervescência, semelhante à produzida na reação de Grossman, com liberação de oxigênio nascente. A adição de EDTA proporciona a esta associação a ação quelante sobre o cálcio das paredes dos canais radiculares.
Pécora (1985) constatou que o uso do creme RC-PREP com Hipoclorito de sódio a 5% promovia aumento da permeabilidade dentinária de modo menos intenso do que a utilização da solução de EDTA e das soluções halogenadas nas diferentes concentrações, quando utilizadas individualmente.
9- Peróxido de uréia + Tween 80 + Carbowax (EN-DO-PTC) neutralizado com solução de Dakin
Paiva & Antoniazzi (1973) modificaram a fórmula proposta por Stewart et al (1969),substituindo o EDTA pelo Tween 80 no creme e no lugar de se usar o Hipoclorito de sódio a 5%, eles preconizaram a neutra-lização do peróxido de uréia com o líqïido de Dakin. Cumpre informar que a reação quimica que se processa durante o uso da proposta de Stewart et al (1969) e Paiva & Antoniazzi (1973) é a mesma, a única diferença é a intensidade da reação em virtude das concentrações das soluções de hipoclorito de sódio utilizadas.
No que concerne às associações e misturas muitas coisas ainda podem e devem ser investigada, pois a ciência só avança diante de pontos de vitas divergentes. As concordâncias unamimes correspondem à estagnações e retrocessos.
![]()
AUERBACH, M. B. Antibiotics vs instrumentation in endodontic. NY St Dent J., v. 19, n. 5, p. 225-8, 1953. BADAN, M. Oxigenoargentoterapia. Mogi-Mirim, Pacini & Piccolomini, 1949.
BARBIN, E. L.; SPANÓ, J. C. E.; SILVA, R. S.; PÉCORA, J. D. Análise "in vitro" da variação térmica durante o uso do hipoclorito de sódio, em diferentes concentrações, com peróxido de hidrogênio a 3%. Rev. Odontol. Univ. São Paulo, v. 9, n. 3, p. 189-192, jul./set. 1995.
BARBIN, E. L. Estudo "in vitro" do efeito da adição de lauril dietilenoglicol éter sulfato de sódio nas soluções de hipoclorito de sódio sobre suas Propriedades físico-químicas anteriores e posteriores à dissolução do tecido pulpar bovino. Ribeirão Preto, 1999, 108p. Dissertação (Mestrado) - Faculdade de Odontologia de Ribeirão Preto, Universidade de São Paulo.
BRANCINI, M.R.; BRAMANE, C.M.; BERBERT, A. Poder de limpeza de algumas soluções irrigadoras analisadas pela microscopia de varredura. Rev. Paul. Endodont. 4 (1/14): 116-23, jan./dez., 1983
CALLAHAN, J.R. Sulguric acid for opening root-canals. Dent. Cosmos, n. 36, v. 12, p. 957-59, 1894.
COBE, S. Investigations of a new dental chemotherapeutic agent in presence of blood. Oral Surg., v. 13, n. 1, p. 678-85, 1960.
COHEN, S; STEWART, G.G.; LASTER, L.L. The effects of acids, al.kal.ies, and chelating agents on dentine permeability. Oral. Surg., 29(4):631-634, Apr. 1970.
COSTA, W. F.; WATANABE, I.; ANTONIAZZI, J.H.; PÉCORA, J.D.; NUTI-SOBRINHO, A.; LIMA, S.M.N.: Estudo comparativo através do M.E.V. da limpeza de canais radiculares quando da instrumentação manual e ultrasônica. Rev. Paul. Odont., 9(6): 10-23, nov./dez., 1986.
COSTA, W.F. Avaliação da elevação da temperatura produzida pela reação exotérmica de algumas associações de substâncias químicas utilizadas no preparo do canal radicular. Ribeirão Preto, 1987. 147p. Tese (Livre Docência) - Faculdade de Odontologea de Ribirão Preto, Universidade de São Paulo.
COSTA, W.F.; ANTONIAZZI, J.H.; CAMPOS, M.N.M.; PÉCORA, J.D.; ROBAZZA, C.R.C.: Avaliação comparativa sob microscopia ótica, da capacidade de limpeza da irrigação manual convencional versus ultrasônica dos canais radiculares. Rev. Paul. Odont., 8(5): 50-60, set./out., 1986.
COSTA, W.F.; ANTONIAZZI, J.H.; PÉCORA, J.D.: Avaliação da instrumentação ultrasônica na limpeza dos canais radiculares quando realizado no comprimento de trabalho e aquém do comprimento do trabalho, 1995 (no prelo)
CRUZ FILHO, A. M. Ação do EDTAC sobre a microdureza da dentina radicular, após diferentes tempos de aplicação. 1994, 86 p. Tese de Mestrado. Faculdade de Odontologia de Ribeirão Preto da USP.
DAKIN, H.D. In the use of certain antiseptic substances in the treatment of infected wounds. Br. Med. J., (2):318-320, Aug. 1915.
FAIRBANKS, D. C. O. Avaliação da capacidade quelante do EDTA, do EDTAC e do EDTA-T pela análise da microdureza da dentina radicular. Rio de Janeiro, 1995, 82 p. Tese de Mestrado. Faculdade de Odontologia da Universidade Estdual do Rio de Janeiro - UERJ.
GROSSMAN, L.I. Irrigation of root canal.s. J. Amer. Dent. Assoc., 30(12):1915-1917, Dec. 1943.
GROSSMAN, L.I.; MEINAM, B.W. Solution of pulp tissue by chemical. agents. J. Amer. Dent. Assoc., 28(2):223-225, Feb. 1941.
GUIMARAES, L.F.L.; ROBAZZA, C.R.C.; MURGEL, C.A.F.; PECORA, J.D. Tensão superficial. de al.gumas soluções irrigantes dos canais radiculares. Rev. Odont. USP, 2(1):6-9, jan./mar., 1988.
HAND,R.E.; SMITH, M.L.; HARRISON, J.W. Anal.ysis of the effect of dilution on the necrotic tissue dissolution property of sodium hypochlorite. J. Endodontics, 4(4):60-64, 1978.
INGLE, J. I. and ZELDOW, B. J. An evaluation of mechanical instrumentation and the negative culture in endodontic therapy. J.A.D.A., v. 50, p. 471, 1958.
KIRK, E.C. Sodium Peroxid, a new dental. bleaching agent an antiseptic. Dental. Cosmos, 35(2):192-198, Feb. 1893.
LEONARDO, M. R. Contribuição para o estudo dos efeitos da biomecânica e da medicação tópica na desinfecção dos canais radiculares. (Tese). Araraquara, SP, Brasil, 1965.
LEONARDO, M.R.; LEAL., J.M. Endodontia: Tratamento dos canais radiculares. 2 Ed. Panamericana, São Paulo, 1991.
LOEL, D.A.: Use of acid cleaser in endodontic therapy. J. Amer. dent. Assoc. 90(1): 148-51 Jan., 1975
MARCHESAN, M.A.; SOUZA, R.A.; GUERISOLI, D.M.Z.; SILVA, R.S.; PÉCORA, J.D. Análise de algumas propriedades físico-químicas das águas sanitárias encontradas no mercado brasileiro. Rev. Bras. Odontol. 55(50): 301-3, 1998.
McCOMB, D.; SMITH, D.C. A preliminary scanning electron microscopic study of root canal. after endodontic procedures. J Endodontics, 1(7):238-242, July, 1975.
MOODNIK, R.M.; DORN, S.O.; FELDMAN, M.J.; LEVEY, M.; BORDEN, B.G. Efficacy of biomechanical. instrumentation: a scanning electron microscopic study. J Endodontics, 2(9): 261-266, Sept. 1976.
MOORER, W.R.; WESSELINK, P.R. Factors promoting the tissue dissolving capability of sodium hypochlorite. Int. Endod. J. 15(4):186-187, 1982.
NICHOLLS, E. The efficacy of cleasing of the root canal. Br. Dent. J., 112(2):167-170, Feb. 1962.
PAIVA, J.G.: Irrigação e aspiração em Endodontia. R.G.O., 7 (4): 162, jul./agost. 1959.
PAIVA, J.G.; ANTONIAZZI, J.H. O uso de uma associação de peróxido de uréia e detergente (Tween 80) no preparo químico-mecânico dos canais radiculares. Rev. Assoc. Paul. Cir. Dent.,27(7):416-422, dez., 1973.
PÉCORA, J.D. Contribuição ao estudo da permeabilidade dentinária radicular. Apresentação de um método histoquímico e análise morfométrica. Ribeirão Preto, 1985, 110p.Dissertação de Mestrado. Faculdade de Odontologia de Ribeirão preto da USP.
PÉCORA, J.D. Efeito das soluções de Dakin e de EDTA, isoladas, al.ternadas e misturadas, sobre a permeabilidade da dentina radicular. Ribeirão Preto, 1993, 148p Tese de Livre-Docente. Faculdade de Odontologia de Ribeirão Preto, USP.
PÉCORA, J.D. Estudo da permeabilidade dentinária do assoal.ho da câmara pulpar dos molares inferiores humanos, com raízes separadas. Ribeirão Preto, 1990, 117p. Tese de Doutorado. Faculdade de Odontologia de Ribeirão Preto da USP.
PÉCORA, J.D.; GUIMARÃES, L.F.; SAVIOLI, R.N. Surface tension of several. drugs used in endodontics. Braz. Dent. J. 2(2):123-129 1992.
ROBAZZA, C.R.C. Contribuição ao estudo"in vitro" da permeabilidade dentinária radicular quando do emprego de al.gumas substâncias de uso endodôntico. Ribeirão preto, 1973, 92p. Tese de Doutorado Faculdade de Odontologia de Ribeirão Preto, USP.
SAVIOLI, R.N.; COSTA, W.F.; SAQUY, P.C.; ANTONIAZZI, J.H.; PÉCORA, J.D.: Estudo comparativo entre o hipoclorito de sódio e o ácido cítrico na capacidade de limpeza do canal radicular. Rev. Odonto USP, 7 (4): 273-7, out./dez., 1993.
SCHREIER, E. The treatment of infected root-canals wity kalium and natrium. Dent. Cosmos, v. 35, n. 9, p. 863-69, 1893.
SANTOS, T.C. ESTUDO "IN VITRO" DO EFEITO DO AUMENTO DA TEMPERATURA DAS SOLUÇÕES DE HIPOCLORITO DE SÓDIO SOBRE SUAS PROPRIEDADES FÍSICO-QUÍMICAS ANTERIORES E POSTERIORES À DISSOLUÇÃO DO TECIDO PULPAR BOVINO. Ribeirão Preto, 1999, 108p. Dissertação (Mestrado) - Faculdade de Odontologia de Ribeirão Preto, Universidade de São Paulo.
SENIA, S.E.; MARSHALL, J.F. & ROSEN, S. The solvent action of sodium hypochlorite on pulp of extracted teeth. Oral Surg., 31(1):96-103, Jan. 1971.
SHIH, S.E.; MARSHALL, J.F.; ROSEN, S.: The bactericidal efficiency of sodium hypochlorite as an endodontic irrigant. Oral Surg., 29(4): 613-19, April 1970.
SPANO, J.C.E. Estudo "in vitro" das propriedades físico-químicas das soluções de hipoclorito de sódio, em diferentes concentrações, antes e após a dissolução de tecido pulpar bovino. Ribeirão Preto, 1999, 96p. Dissertação (Mestrado) - Faculdade de Odontologia de Ribeirão Preto, Universidade de São Paulo.
STEWART, G. G. The importance of chemomechanical preparation of root canal. Oral Surg., v. 8, n. 9, p. 993-97, 1955.
STEWART, G. G.; COBE, H. M.; RAPPAPORT, H. A study of a new medicament in chemomichanical preparation of infected root canals. J. Amer. Dent. Ass., v. 63, n. 1, p. 33-7, 1961.
STEWART, G.G.; KAPSIMAL.S,P.; RAPPAPORT, H. EDTA and urea peroxide for root canal. preparation. J. Am. Dent. Assoc. 78 (2):335-338,1969.
TREPAGNIER, C.M.; MADDEN, R.M. & LAZZARI, E.P. Quantitative study of sodium hypochlorite as an in vitro endodontic irrigant. J. Endod., 3(5):194-196, May, 1977.
TUCKER, J.W.; MIZRAHI,S.; SELTZER, S. Scanning electron microscopic study of efficacy of various irrigating solutions: urea, tubulicid red and tubulicid blue. J. Endodontics, 2(3):71-77, Mar. 1976.
VARELLA, J.A.F. & PAIVA, J.G.: Manual de Endodontia. 2 Ed., São Paulo, Atheneu, 1969. 226p.
VIANNA, M. M. A soda clorada e as culturas negativas. Rev. Gaucha Odontol., v. 15, n. 2, p. 43-6, 1967.
WAL.KER, R.E. A definite and dependable therapy for pulpless teeth. J. Amer. Dent. Assoc. 23(2):1418-1425, aug. 1936.
WITTGOW, W. C.; SABISTON, C. B. Jr. Microorganisms from pulpal chambers of intact teeth eith necrotic pulps. J. Endodon., v. 1, n. 5, p. 168-71, 1975.
ZUOLO, M; MURGEL, C.A.F.; PÉCORA,J.D.; ANTONIAZZI,J.H.;COSTA, W.F. Ação do EDTA e suas associações com tensoativos na permeabilidade da dentina radicular. Rev. Odont. USP 1(4):18-23, out./dez. 1987.
![]()
Lab. Endodontia | Disciplina de Endodontia | Ir à página de Métodos de Pesquisa |
Departamento de Odontologia Restauradora | FORP-USP | USP | Web Masters
|
Atualizada em 03/11/2004 |